Beta-Laktam-Antibiotika enthalten als Teil ihrer chemischen Struktur einen Beta-Laktam-Ring. Arzneimittel dieser Klasse umfassen Penicillin G und V, Penicillinase-empfindliche und Penicillinase-resistente Penicilline, Cephalosporine Cephalosporine Cephalosporine, Carbapeneme Carbapeneme Carbapeneme und Aztreonam und Monobaktame. Die Wirkung von Penicillinen und anderen Beta-Laktam-Antibiotika beruht auf der Blockade der bakteriellen Transpeptidase (Penicillin-bindendes Protein, PBP), wodurch die Peptidoglykan-Vernetzung der bakteriellen Zellwand gestoppt wird. Alle Beta-Laktam-Antibiotika wirken bakterizid. Häufige Mechanismen der Resistenz von Bakterien gegenüber Penicillinen umfassen die Produktion einer Penicillinase oder Mutationen im PBP-Gen. Die häufigsten Nebenwirkungen von Penicillinen umfassen Allergien, gastrointestinale Störungen und eine hämolytische Anämie hämolytische Anämie Anämie: Überblick und Formen.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Penicilline gehören zu den Beta-Laktamen und bestehen aus:

Struktur von Beta-Laktamen:
Alle Beta-Lactam-Antibiotika enthalten den gleichen viergliedrigen Beta-Laktam-Ring (rot hervorgehoben). Dieser Ring ist für die antibakteriellen Eigenschaften des Arzneimittels verantwortlich, da er die Region ist, die an Penicillin-bindende Proteine (PBP) bindet und diese hemmt. PBP kommen nur bei Bakterien, nicht aber beim Menschen vor. Sie katalysieren die Zellwandbildung bei Bakterien, indem sie Querverbindungen zwischen den Peptidketten in den Peptidoglykanmolekülen herstellen. PBP bilden diese Querverbindungen zwischen Acyl-D-Ala-D-Ala-Peptiden, die eine ähnliche Struktur wie der Beta-Lactam-Ring aufweisen.
Penicilline
Bild: „Strukturen verschiedener Penicilline“ von Roland Mattern. Lizenz: Public DomainAlle Beta-Laktame, einschließlich der Penicilline, üben ihre Wirkung durch Hemmung der bakteriellen Zellwandsynthese aus.

Aufbau bakterieller Zellwände
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0Alle Beta-Laktame wirken über eine irreversible Hemmung der PBP → Beta-Laktam-Antibiotika hemmen die Zellwandsynthese.

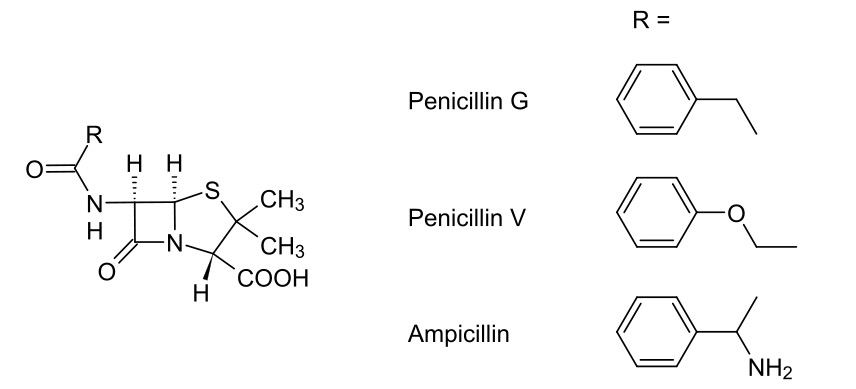
(1) Penicillin-bindende Proteine (PBP) stellen Brücken zwischen benachbarten Peptidoglykanketten her.
NAM: N-Acetylmuraminsäure
NAG: N-Acetylglucosamin

(2) Penicillin-bindende Proteine (PBP) stellen Brücken zwischen benachbarten Peptidoglykanketten her.
NAM: N-Acetylmuraminsäure
NAG: N-Acetylglucosamin
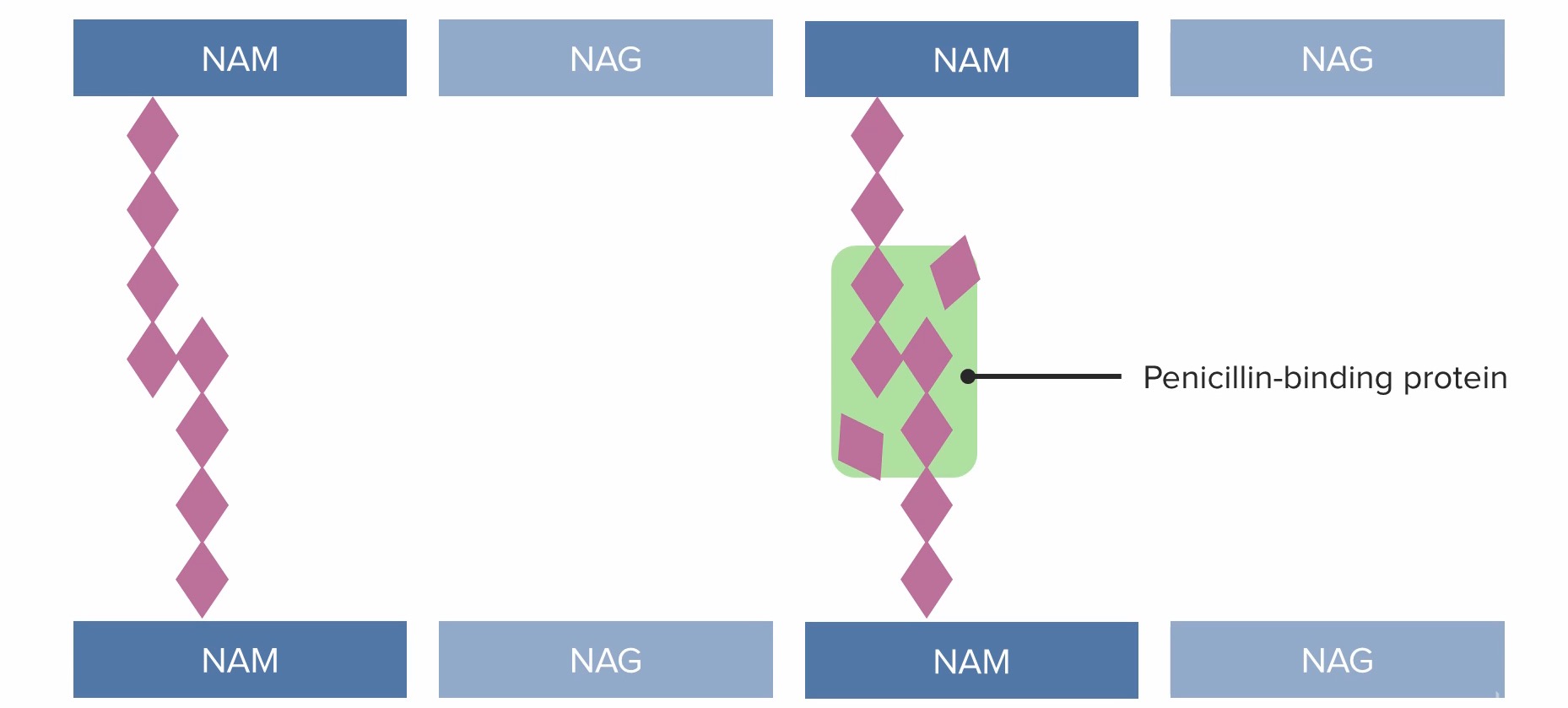
(3) Penicillin-bindende Proteine (PBP) stellen Brücken zwischen benachbarten Peptidoglykanketten her.
NAM: N-Acetylmuraminsäure
NAG: N-Acetylglucosamin
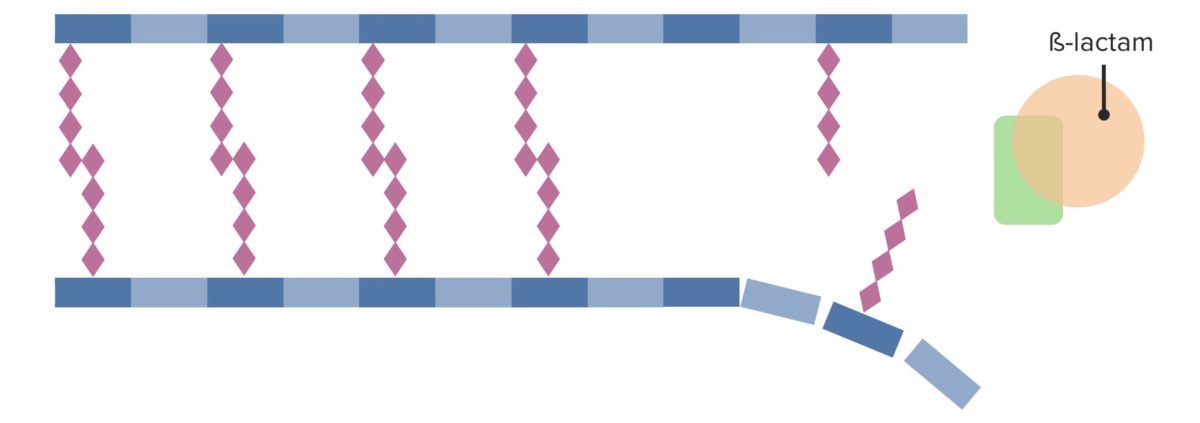
Ein Beta-Laktam-Antibiotikum bindet irreversibel an das PBP und verhindert so die Entstehung neuer Vernetzungen.
Das Beta-Laktam-Antibiotikum hemmt somit die weitere Zellwandsynthese, was letztendlich zum Zelltod führt.
Die Wirkung von Penicillinen (und aller anderen Beta-Laktame), erfolgt bakterizid (nicht bakteriostatisch).

Bakterium, das versucht, sich in Gegenwart von Penicillin zu vermehren:
Das Bakterium wirft seine Wand ab und wird zu einem Sphäroplasten. Der Sphäroplast ist nicht in der Lage, zu überleben und stirbt ab.
Gegen Penicilline können Bakterien drei primäre Mechanismen der Resistenz ausbilden:
Penicilline können in Schmalspektrum- und Breitspektrum-Penicilline eingeteilt werden. Penicilline können auch als penicillinasefest (-resistent) oder als nicht-penicillinasefest (penicillinase-sensibel) klassifiziert werden.
Penicillinasefeste Penicilline haben neben dem Beta-Laktam-Ring eine große R-Gruppe, die den Abbau von Arzneimitteln durch eine Penicillinase verhindert. Penicillinasefeste Penicilline sind gegen Methicillin-sensible Staphylokokken (MSSA) wirksam; daher werden sie allgemein als „(Anti-)Staphylokokken-Penicilline“ oder Isoxazolylpenicilline bezeichnet. Sie besitzen ein sehr schmales Wirkspektrum und sollten nur zur gezielten Therapie gegen MSSA eingesetzt werden.
| Wirkstoff (Applikation) | Wirkspektrum | Klinische Anwendungen |
|---|---|---|
| Penicillin G (i. v./i. m.) und Penicillin V (oral) | Schmal:
|
|
| Flucloxacillin | Schmal: gram-positive Kokken ( Staphylococcus Staphylococcus Staphylococcus spp., außer MRSA) Sonst wie Penicillin G, aber im Vergleich dazu schwächere Wirkung, daher Penicillin G in diesen Fällen bevorzugen |
|
| Ampicillin (i. v./oral) und Amoxycillin (oral) | Breit:
|
|
| Piperacillin/ Tazobactam Tazobactam Cephalosporine | Noch breiter:
|
|
| Mezlocillin | Breit: gute Gram-Negativ-Abdeckung | Gallenwegsinfektionen (z. B. biliäre Cholangitis) |
Die häufigsten Nebenwirkungen von Penicillinen beziehen sich auf allergische Reaktionen.
Antibiotika können auf verschiedene Arten klassifiziert werden, z. B. nach ihrem Wirkmechanismus:
| Mechanismus | Antibiotikaklassen |
|---|---|
| Hemmstoffe der bakteriellen Zellwandsynthese |
|
| Bakterielle Proteinsynthesehemmer |
|
| Wirkstoffe, die gegen DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA und/oder Folsäure wirken |
|
| Antimykobakterielle Wirkstoffe Antimykobakterielle Wirkstoffe Antimykobakterielle Wirkstoffe |
|
Verschiedene Antibiotika haben unterschiedliche Aktivitätsgrade gegen verschiedene Bakterien. In der folgenden Tabelle sind die Antibiotika aufgeführt, die gegen drei wichtige Bakterienklassen wirksam sind, darunter grampositive Kokken, gramnegative Bakterien gramnegative Bakterien Bakteriologie: Überblick und Anaerobier.

Antibiotikaempfindlichkeit:
Abbildung zum Vergleich der Wirkspektren verschiedener Antibiotika für grampositive Kokken, gramnegative Bakterien und Anaerobier.