Angeborene Fehlbildungen oder teratogene Geburtsfehler sind Entwicklungsstörungen, die vor der Geburt während der Embryonal- oder Fetalperiode auftreten. Die Inzidenzrate für lebend geborene Kinder liegt bei etwa 3 %. Die Ursache kann genetisch bedingt sein oder durch äußere Einflüsse oder Teratogene bedingt sein. Teratogene sind Umweltfaktoren, die zu dauerhaften strukturellen oder funktionellen Fehlbildungen oder zum Tod des Embryos oder Fetus führen. Teratogene umfassen Infektionen, bestimmte Medikamente, Drogen und Strahlung.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Primäre Fehlbildungen:
Sekundäre Fehlbildungen:
Doppelfehlbildungen oder „siamesische Zwillinge“:
Zwei Föten, die durch unvollständige Abgrenzung des Embryoblasten Embryoblasten Entwicklung von Embryoblast und Trophoblast im Blastozystenstadium (13. Tag), zusammengewachsen sind:
Die Entwicklung von Fehlbildungen variiert in unterschiedlichen Stadien der embryonalen/fetalen Entwicklung und wird als phasenabhängige Vulnerabilität bezeichnet.
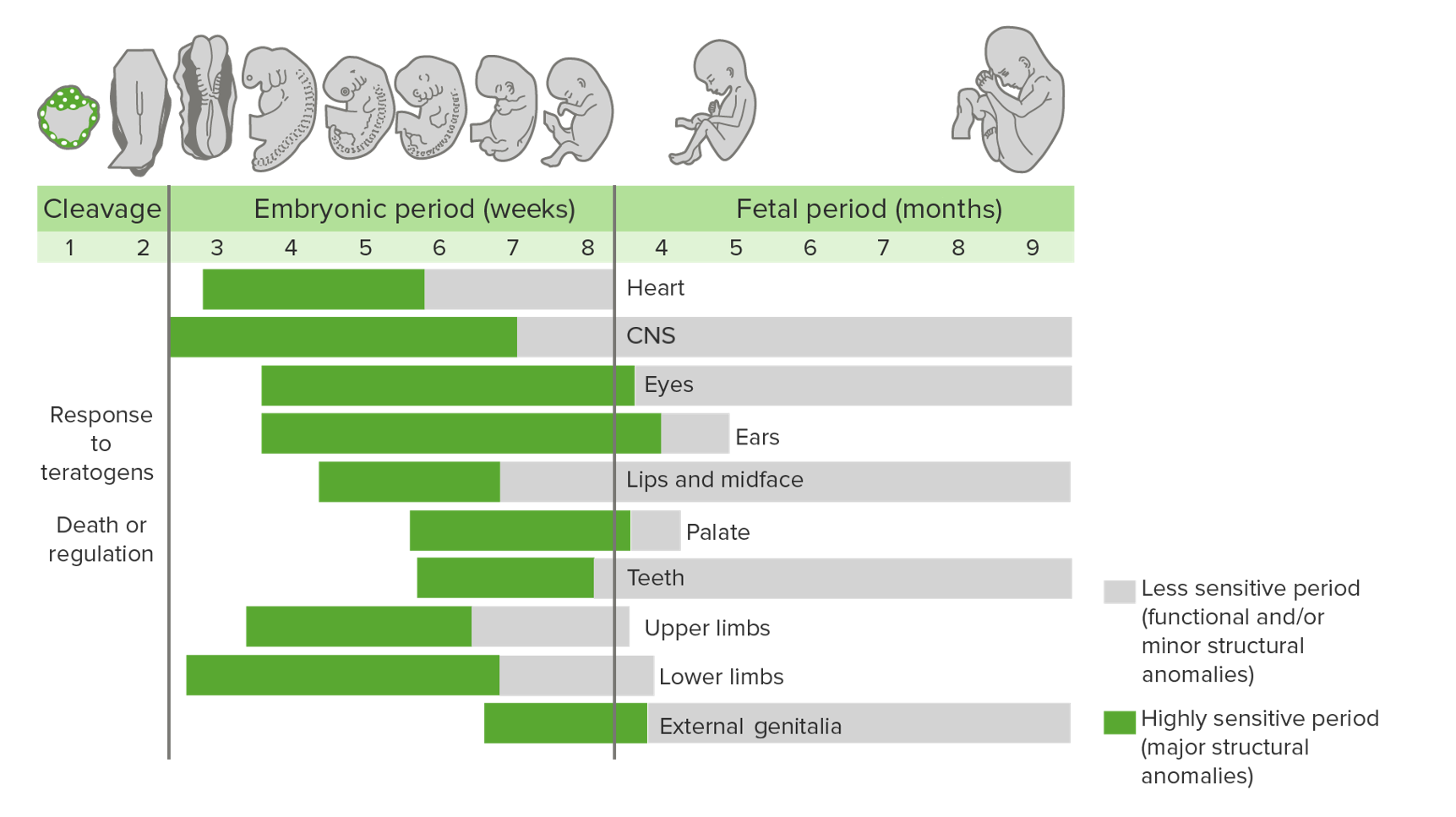
Zeiträume innerhalb der Schwangerschaft, in denen Organsysteme am anfälligsten für Teratogene sind:
Grau: weniger empfindliche Periode (funktionelle und/oder geringfügige strukturelle Anomalien)
Grün: hochsensibler Zeitraum (große strukturelle Anomalien)
Alkoholmissbrauch → Fetale Alkoholspektrumstörung Fetale Alkoholspektrumstörung Fetale Alkoholspektrumstörung (FASD) / fetales Alkoholsyndrom Fetales Alkoholsyndrom Alkoholabhängigkeitssyndrom und alkoholbezogene Störungen (FAS → schwerstgradigstes Ende des Spektrums für alkoholbedingte Defekte)

Charakteristische Gesichtszüge einer Person mit fetaler Alkoholspektrumstörung
Bild : „FASkid“ von NIH/National Institute on Alcohol Abuse and Alcoholism. Lizenz: Public DomainMedikamente, die während der Schwangerschaft Schwangerschaft Schwangerschaft: Diagnostik, mütterliche Physiologie und Routineversorgung kontraindiziert sind, und die möglichen Komplikationen, mit denen sie assoziiert sind, sind wie folgt:
Mehrere Präventionsstrategien können das Auftreten von Fehlbildungen deutlich senken. Sie sollten größtenteils schon vor der Konzeption Anwendung finden.