Cephalosporine sind eine Gruppe von bakteriziden Beta-Lactam-Antibiotika (ähnlich den Penicillinen), die über eine Behinderung der bakteriellen Zellwandsynthese wirken, was letztendlich zum Zelltod Zelltod Zellschäden und Zelltod führt. Cephalosporine sind nach Generationen klassifiziert und alle Arzneimittelnamen beginnen mit „cef-“ oder „ceph-“. Cephalosporine haben im Vergleich zu den meisten Penicillinen eine erhöhte antimikrobielle Aktivität und sind wirksamer gegen Enterobacteriaceae ; einige Medikamente sind auch gegen Pseudomonas Pseudomonas Pseudomonas und/oder anaerobe Spezies wirksam. Cephalosporine werden häufig zur Behandlung von Haut-, Weichgewebe-, Knochen-, Lungen-, Harnwegs-, intraabdominalen und Beckeninfektionen verwendet, die durch sensitive Organismen verursacht werden.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Cephalosporine gehören zu den Beta-Lactam-Antibiotika und bestehen aus:

Struktur von Beta-Lactamen:
Alle Beta-Lactam-Antibiotika enthalten den gleichen 4-gliedrigen „Beta-Lactam“-Ring (rot hervorgehoben). Dieser Ring ist für die antibakteriellen Eigenschaften der Wirkstoffe verantwortlich, da er die Region ist, die an Penicillin-bindende Proteine (PBPs) bindet und diese hemmt. Die PBPs katalysieren die Bildung der Zellwand, indem sie Querverbindungen zwischen den Peptidketten in den Peptidoglykanmolekülen erzeugen; PBPs bilden diese Querverbindungen zwischen Acyl-D-Ala-D-Ala-Peptiden, die eine ähnliche Struktur wie der Beta-Lactam-Ring aufweisen.
Alle Beta-Lactame, einschließlich Cephalosporine, üben ihre Wirkung durch Hemmung der bakteriellen Zellwandsynthese aus.

Aufbau bakterieller Zellwände
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0Alle Beta-Lactame wirken, indem sie irreversibel an die PBPs binden und diese inhibieren → Beta-Lactam-Antibiotika hemmen die Zellwandsynthese.

(1) Penicillin-bindendes Protein (PBP), das vernetzte Brücken zwischen benachbarten Peptidoglykanketten bildet
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0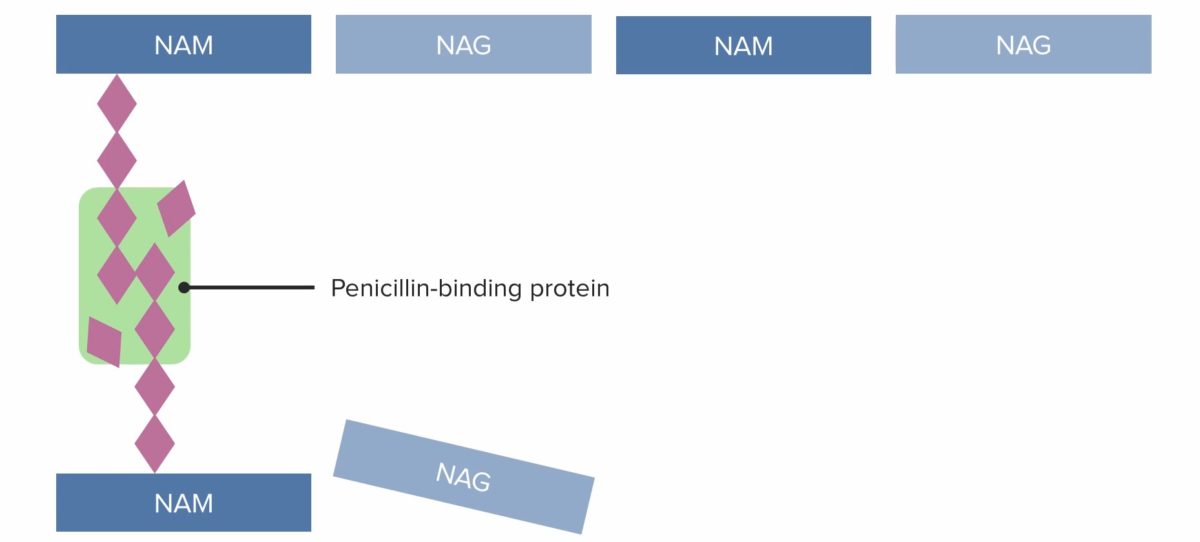
(2) Penicillin-bindendes Protein (PBP), das vernetzte Brücken zwischen benachbarten Peptidoglykanketten bildet
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0
(3) Penicillin-bindendes Protein (PBP), das vernetzte Brücken zwischen benachbarten Peptidoglykanketten bildet
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0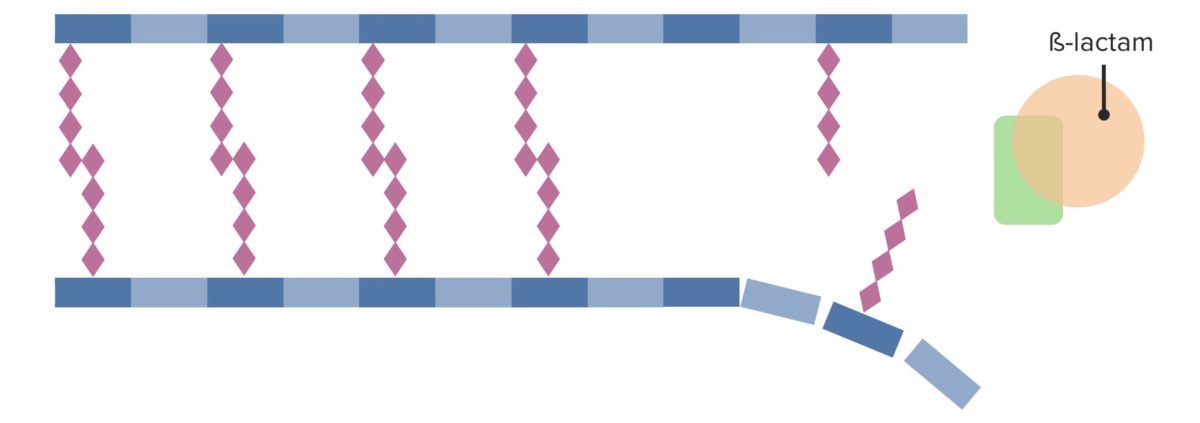
Vorhandensein eines Beta-Lactam-Antibiotikums, das irreversibel an das PBP bindet und es somit inhibiert, sodass keine neuen Quervernetzungen mehr gebildet werden können:
Wirksame Hemmung der weiteren Zellwandsynthese, die letztendlich zum Zelltod führt
Beta-Lactame, einschließlich Cephalosporine, wirken bakterizid (und nicht bakteriostatisch).

Bakterium, das versucht, sich in Gegenwart von Penicillin zu teilen:
Das Bakterium stößt seine Wand ab und wird zu einem Sphäroplasten. Der Sphäroplast ist nicht in der Lage zu überleben und autokatalysiert (stirbt).
Bakterien nutzen 3 primäre Mechanismen, wodurch sie gegenüber Cephalosporinen resistent sind:
Daher sollte Ceftriaxon nicht rekonstituiert/direkt mit kalziumhaltigen Produkten wie Ringer-Laktat oder totaler parenteraler Ernährung gemischt werden.
Cephalosporine werden im Allgemeinen nach Generationen eingeteilt, wobei die Wirkstoffe der 1. Generation die ältesten in dieser Klasse sind. Einige der am häufigsten verwendeten Medikamente sind in der folgenden Tabelle aufgeführt.
| Generation | Parenterale Wirkstoffe | Orale Wirkstoffe |
|---|---|---|
| 1. Generation | Cefazolin | Cefalexin |
| 2. Generation |
|
Cefuroxim, Cefotiam |
| 3. Generation |
|
|
| 4. Generation | Cefepim | Keine |
| 5. Generation und erweiterte Kombinationen |
|
Keine |
| Wirkstoffe | Gram-positive Kokken | Gram-negative Stäbchen | Gram-negative Kokken | Anaerobier | ||
|---|---|---|---|---|---|---|
| Streptokokken Streptokokken Streptococcus, Methicillin-sensibler Staphylococcus Staphylococcus Staphylococcus aureus (MSSA) |
|
SPACE-Organismen | Pseudomonas Pseudomonas Pseudomonas | Neisseria Neisseria Neisseria spp | Peptostreptokokken | |
1. Generation
|
x | X* | x | |||
2. Generation
|
x | x | X** | X + | ||
3. Generation
|
x | x | X ++ | x | x | |
4. Generation
|
x | x | x | x | X + | |
5. Generation und Kombinationen:
|
x | x | x | x | X + | |
Cephalosporine werden zur Behandlung von Infektionen angewendet, die durch sensitive Organismen verursacht werden, einschließlich:
Allergische Reaktionen sind die häufigsten Nebenwirkungen.
Antibiotika können auf verschiedene Arten klassifiziert werden. Eine Möglichkeit besteht darin, sie nach ihrem Wirkmechanismus zu klassifizieren:
| Mechanismus | Antibiotikaklassen |
|---|---|
| Hemmstoffe der bakteriellen Zellwandsynthese |
|
| Bakterielle Proteinsynthesehemmer |
|
| Wirkstoffe, die gegen DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA und/oder Folat Folat Folsäure und Vitamin B12 wirken |
|
| Antimykobakterielle Wirkstoffe Antimykobakterielle Wirkstoffe Antimykobakterielle Wirkstoffe |
|
Verschiedene Antibiotika weisen unterschiedliche Wirkungsstärken gegen verschiedene Bakterien auf. In der folgenden Tabelle sind die Antibiotika aufgeführt, die gegen 3 wichtige Bakterienklassen wirksam sind, darunter grampositive Kokken, gramnegative Stäbchen und Anaerobier.

Antibiotikaempfindlichkeit:
Diagramm zum Vergleich der mikrobiellen Abdeckung verschiedener Antibiotika für grampositive Kokken, gramnegative Stäbchen und Anaerobier.