Das Mammakarzinom (Brustkrebs) ist eine Erkrankung, die durch eine maligne Transformation von Epithelzellen der Brust gekennzeichnet ist. Das Mammakarzinom ist das häufigste Karzinom und die häufigste krebsbedingte Todesursache bei Frauen*. Genetische Faktoren, Alter, sowie hormonelle und umweltbedingte Einflüsse tragen zum Progress der Erkrankung bei. Der häufigste histologische Typ ist das invasive Karzinom ohne speziellen Typ (früher: invasiv-duktales Karzinom, nicht anders spezifiziert), welcher > 75 % aller Mammakarzinome ausmacht. Zur Früherkennung wird ein Mammografie-Screening empfohlen. Die Diagnose wird mittels einer Biopsie gestellt, wobei eine molekulare Subtypisierung anhand immunhistochemischer Untersuchungen erfolgt. Operative Verfahren, systemische Therapie (Chemotherapie, biologische Therapie, endokrine Therapie) und Radiotherapie (RT) sind Teile der Therapie des lokal begrenzten und lokal fortgeschrittenen Karzinoms. Bei metastasiertem Mammakarzinom wird eine systemische Therapie mit palliativen Maßnahmen eingesetzt.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Nicht modifizierbare Risikofaktoren:
Modifizierbare Risikofaktoren:
Eselsbrücke:
„BReast-CAncer 1 und 2“: Mutierte Gene sind die Gene BRCA1 und BRCA2.
Risikoläsionen (nicht invasiv):
Invasive Karzinome:
Andere klinische Formen:
Basierend auf Expression von:
Immunhistochemische molekulare Subtypisierung:

Modell der Tumorprogression des Mammakarzinoms:
Von links nach rechts: Normale duktale Gänge bestehen aus der Basalmembran und einer Schicht luminaler Epithel- und Myoepithelzellen. Das Stroma umfasst verschiedene Leukozyten, Fibroblasten, Myofibroblasten und Endothelzellen. In situ -Karzinome: Die myoepithelialen Zellen sind epigenetisch und phänotypisch verändert und ihre Zahl nimmt ab, möglicherweise aufgrund des Abbaus der Basalmembran. Die Stromafibroblasten, Myofibroblasten, Lymphozyten und Endothelzellen nehmen zu. Bei invasiven Karzinomen kommt es zu einem Verlust von Myoepithelzellen und der Basalmembran, bei denen Tumorzellen in umliegendes Gewebe eindringen können. Die Tumorzellen wandern in entfernte Organe und führen schließlich zu Metastasen.
In Gebieten mit etabliertem Brustkrebs-Screening Brustkrebs-Screening Brustkrebs-Screening: Die meisten Mammakarzinome werden durch eine auffällige Mammografie diagnostiziert.
Symptomatik:
Anzeichen:

Mögliche Zeichen eines Mammakarzinoms
Von rechts nach links, von oben nach unten: Brustknoten/-verhärtung, Hauteinziehung, Veränderung der Hautfarbe/-textur, Veränderungen der Mamille einschließlich Retraktion (Einziehen der Brustwarze) und Ausfluss

Duktales Karzinom in situ
DCIS: duktales Karzinom in situ
BM: Basalmembran
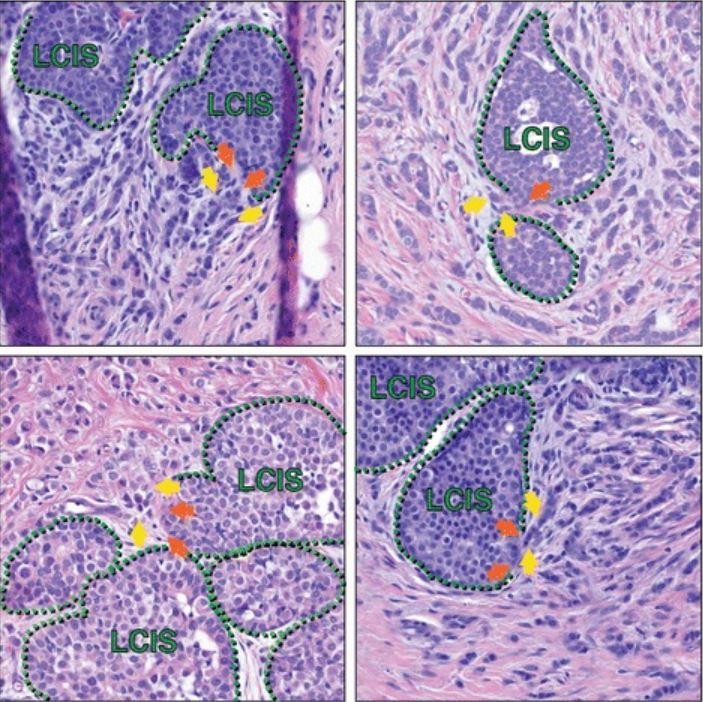
Lobuläre intraepitheliale Neoplasie (LIN)/Lobuläres Karzinom in situ>/i> in Verbindung mit invasivem lobulärem Karzinom (ILC):
Histologische Schnitte von mehreren Patient*innen erfassen Bereiche von LCIS, die neben dem ILC eine fokale Störung der Myoepithelschicht zu haben scheinen, was auf eine mögliche Progression von LCIS zu ILC an solchen Übergängen hindeutet. Grüne schraffierte Linien markieren die myoepitheliale Schicht; orangefarbene Pfeile sind mögliche Herde einer myoepithelialen Störung; gelbe Pfeile markieren invasive Zellen. Zusätzlich zu den mit gelben Pfeilen markierten Zellen sind in jedem Bild im gesamten Stroma weitere ILC-Zellen vorhanden, die die Bereiche des LCIS umgeben.
| DCIS | LCIS | |
|---|---|---|
| Auftreten | Unifokal | Multifokal |
| Muster |
|
Solide |
| Verkalkung | Ja/Nein | Normalerweise nein |
| Entartungsrisiko | Höher | Niedriger |
| Lokalisation des Karzinoms | Ipsilaterale Brust | Ipsilateral oder kontralateral |
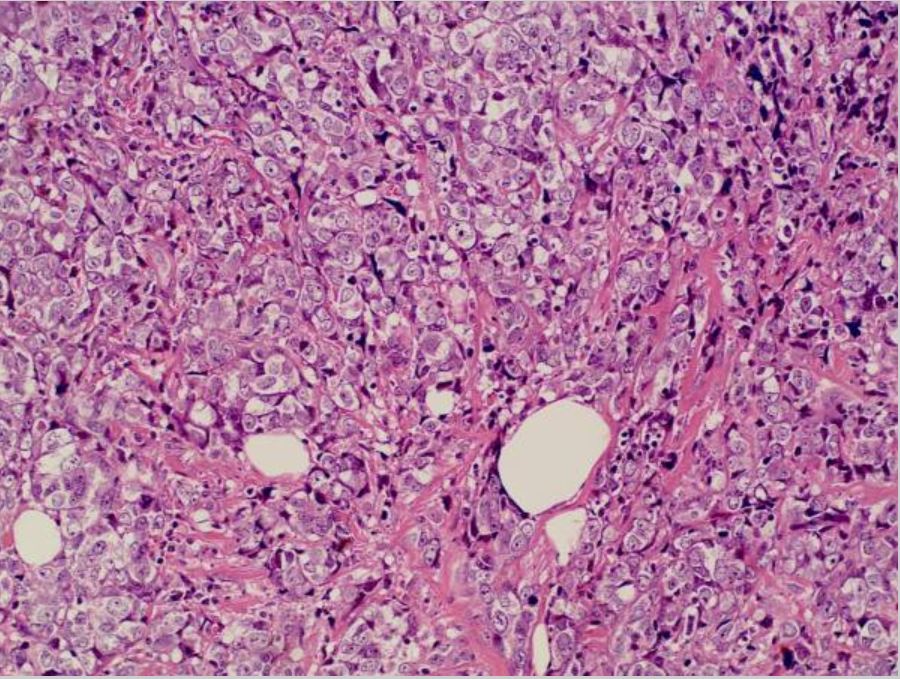
Mammakarzinom: invasives Karzinom ohne speziellen Typ in der linken Brust
Bild: „Invasive ductal breast cancer metastatic to the sigmoid colon“ von Zhou XC, Zhou H, Ye YH, Zhang XF, Jiang Y. Lizenz: CC BY 2.0
Lobuläres Karzinom: invasiv-lobuläres Karzinom der rechten Brust und LCIS (amplifiziert 20×10)
Bild : „Case report of small bowel obstruction caused by small intestinal metastasis of bilateral breast cancer” von Lv L, Zhao Y, Liu H, Peng Z. Lizenz: CC BY 3.0.
Morbus Paget der Mamille: Veränderungen der Warzenhöfe der linken Brustwarze
(a) Das Foto der linken Brust zeigt Hautverdickung, Erythem, Erosion der Brustwarze und Schuppung um den Mamillen-Areola-Bereich.
(b) Mammogramm zeigt vereinzelte stäbchenförmige Verkalkungen und Gruppen von pleomorphen, feinen, linearen Mikroverkalkungen im inneren Quadranten (Pfeile). Die einfache Mastektomie zeigte ein DCIS und sekretorische Verkalkungen in der Brust bei Morbus Paget der Mamille.
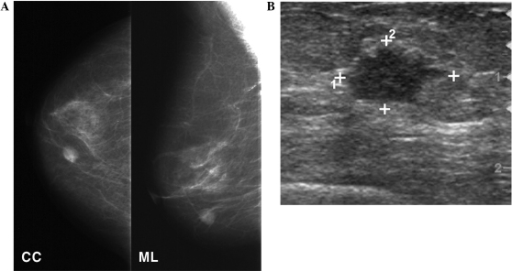
Mammografie und Sonografie der Brust:
A: Die Mammografie zeigt eine runde, hochdichte Raumforderung im unteren inneren Quadranten der rechten Brust.
B: Die sonografische Untersuchung zeigt eine 1,3 cm große, unregelmäßig geformte, echoarme Raumforderung in der Brust.
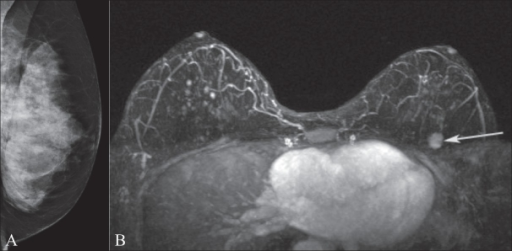
Mammografie und Brust-MRT
A zeigt die Mammografie der linken Brust bei einer Person mit BRCA1 -Gen-Mutation. Zu beachten ist das extrem verdichte Brustgewebe.
MRT B zeigt eine anreichernde Raumforderung (Pfeil) in der oberen linken Brust, die im Mammogramm okkult war.

MRT von Brustmetastasen: Bilder zeigen metastatische Brustläsionen in der Leber
A. T1-gewichtetes 3D-Postkontrastbild
B. entsprechendes 3D-Subtraktionsbild
Pfeile zeigen die metastatischen Läsionen an.
| Stadium | Beschreibung |
|---|---|
| Tx | Tumor nicht beurteilbar |
| T0 | Kein Hinweis auf Tumor |
| Tis |
|
| T1 | ≤ 20 mm Tumor in größter Dimension |
| T2 | > 20 mm aber ≤ 50 mm Tumor in größter Ausdehnung |
| T3 | > 50 mm Tumor in größter Dimension |
| T4 | Tumor jeder Größe mit Infiltration der Haut Haut Haut: Aufbau und Funktion oder Brustwand Brustwand Brustwand |
| Stadium | Beschreibung |
|---|---|
| cNX | Regionale Lymphknoten Lymphknoten Lymphsystem können nicht bewertet werden. |
| cN0 | Keine regionalen nodulären Metastasen |
| cN1 | Befall beweglicher axillärer Lymphknoten Lymphknoten Lymphsystem des Levels I–II |
| cN2 | Befall fixierter axillärer Lymphknoten Lymphknoten Lymphsystem des Levels I–II oder klinisch diagnostizierter isolierter Befall ipsilateraler Lymphknoten Lymphknoten Lymphsystem der A. mammaria interna |
| cN3 | Befall supra- oder infraklavikulärer Lymphknoten Lymphknoten Lymphsystem (Level III), gleichzeitiger Befall von axillären und Mammaria-interna-Lymphknoten |
| Stadium | Beschreibung |
|---|---|
| M0 | Kein Hinweis auf Fernmetastasen (klinisch oder radiologisch) |
| M1 | Nachweisbare Fernmetastasen |
| Stadium | Substadium | Tumor | Lymphknoten Lymphknoten Lymphsystem | Metastasen |
|---|---|---|---|---|
| 0 | Tis | N0 | M0 | |
| I |
|
T0-T1 | N1 | M0 |
| II |
|
T0-T3 | N0-N1 | M0 |
| III |
|
T0-T3 | N1-N2 | M0 |
| IV | Jedes T | Jedes N | M1 |
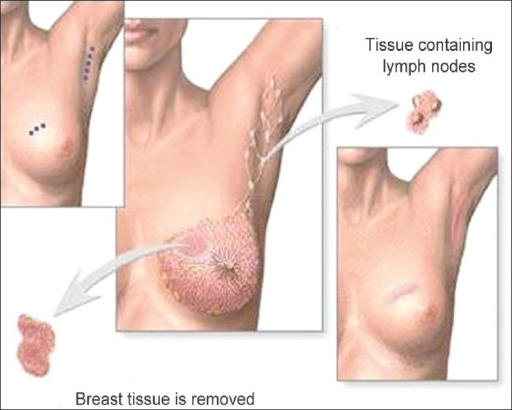
Brusterhaltende Operation (Lumpektomie): Exzision des Tumors mit negativen Resektionsrändern und Befundung der axillären Lymphknoten
Bild: „Phantom breast syndrome“ von Indian Journal of Palliative Care. Lizenz: CC BY 2.0.