Cholesterin ist ein wichtiges Lipidmolekül, welches an viele biologische Funktionen beteiligt ist. Cholesterin kann entweder aus endogenem Acetyl-CoA Acetyl-CoA Citratzyklus: die Drehscheibe des Stoffwechsels synthetisiert oder aus der Nahrung im Magen-Darm-Trakt aufgenommen werden. Da Cholesterin lipophil ist, muss es über Lipoproteine durch den Blutkreislauf transportiert werden, wo es von Hepatozyten Hepatozyten Leber oder peripheren Geweben aufgenommen werden kann. Dort kann Cholesterin gespeichert, in Zellmembranen verbaut oder als Vorstufe für Steroidhormone verwendet werden. Der menschliche Körper kann die Ringstruktur von Cholesterin nicht abbauen, daher besteht der einzige Mechanismus für eine mögliche Ausscheidung in der Produktion von Gallensäuren.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Der Syntheseweg von Cholesterin überschneidet sich mit der Synthese von Ketonkörpern. Die Schritte dieses Prozesses umfassen:
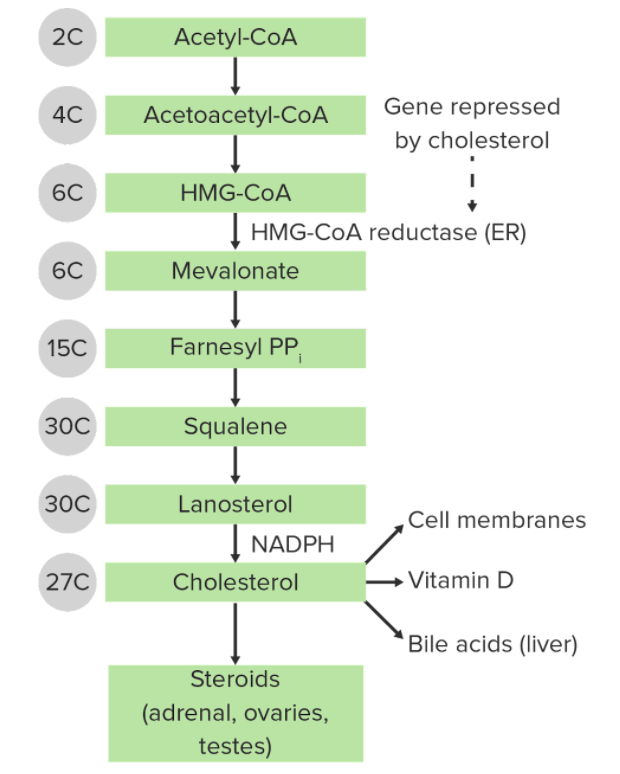
Die Synthese von Cholesterin über den Mevalonat-Weg:
Die Anzahl der Kohlenstoffe innerhalb jeder chemischen Struktur ist links angegeben.
ER: endoplasmatisches Retikulum
HMG-CoA: 3-Hydroxy-3-methyl-glutaryl-coenzym A
PP: Pyrophosphatase
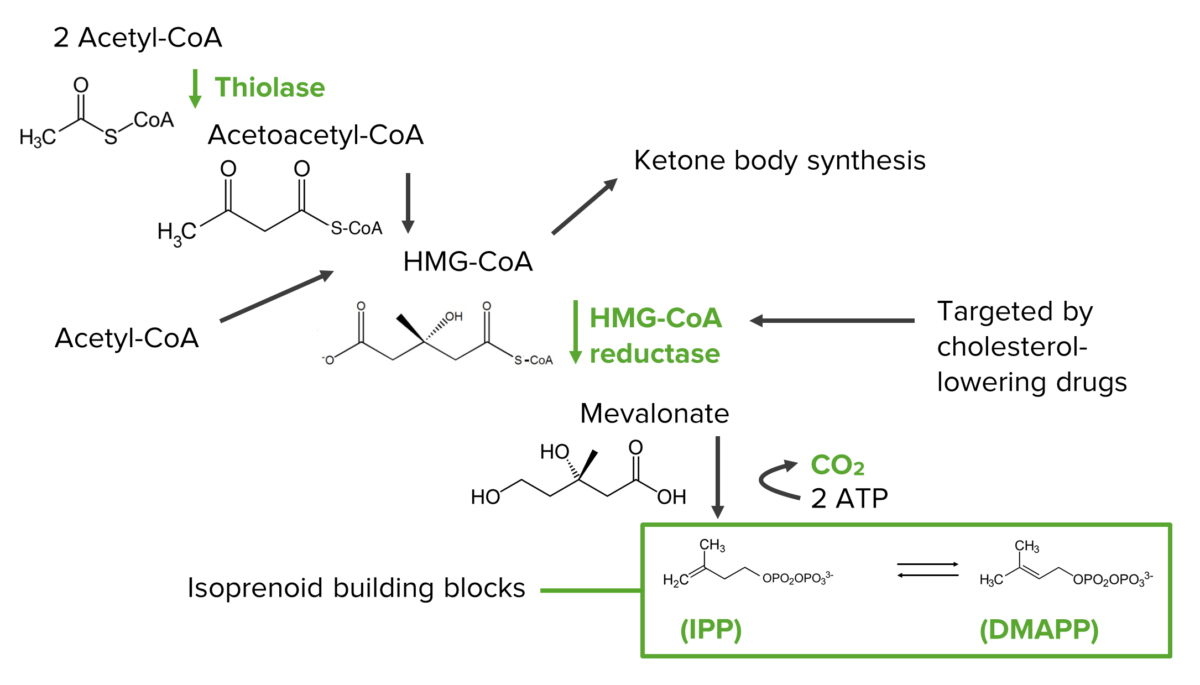
Schritte des Mevalonat-Pfads bei der Synthese der Isoprenoid-Vorläufer, die die Bausteine des Cholesterins sind:
HMG-CoA: 3-Hydroxy-3-methyl-glutaryl-CoA

Schritte des Mevalonat-Pfads von den Isoprenoid-Vorstufen zu Lanosterol
Bild von Lecturio.
| Lipoprotein | Cholesterin/ Cholesterinester |
Triglycerid | Protein | Phospholipid |
|---|---|---|---|---|
| Chylomikronen | 1%/3% | 85% | 2% | 8% |
| VLDL | 7%/10% | 55% | 9% | 20% |
| IDL | 8%/30% | 26% | 11% | 22% |
| LDL | 10%/35% | 10% | 20% | 20% |
| HDL | 4%/12% | 5% | 45% | 25% |

Transportwege von Cholesterin durch den Körper:
Transport im Blut ist grün hervorgehoben.
FFA (englisches Akronym): freie Fettsäure

Exogener und Endogener Zyklus des Cholesterintransports:
Exogener Zyklus und der Aufnahme von Cholesterin (Chol): Nahrungsfett und Cholesterin werden im Darmlumen zu Mizellen umgewandelt und von der Darmwand resorbiert. In der Darmzelle werden diese Lipide von Phospholipiden umhüllt, ähnlich wie in der Zellwand. Das Apolipoprotein (Apo) B-48 wird angehängt und ist für die Freisetzung notwendig. Das Partikel wird nun als Chylomikron bezeichnet und in die Lymphgefäße ausgeschieden, von wo aus es in den Blutkreislauf gelangt. Chylomikronen nehmen Apo C-II und Apo E aus dem HDL auf. Apo C-II aktiviert die Lipoproteinlipase (LPL), die Triglyceride (TG) abbaut. Apo E wird für die Aufnahme von Chylomikronresten in die Hepatozyten verwendet.
Endogener Zyklus des Cholesterintransports und der Cholesterinaufnahme: Die Leber synthetisiert Lipoprotein sehr geringer Dichte (VLDL), das Apo B-100 enthält. Im Blutkreislauf werden Apo C-II und Apo E zwischen VLDL und High-Density-Lipoprotein (HDL) ausgetauscht. Apo C-II aktiviert die LPL, die TGs abbaut. Im Blutkreislauf erleichtert das Cholesterinester-Transferprotein (CETP) den Austausch von TG und Cholesterinestern zwischen HDL und VLDL. Der Rest von VLDL wird als Intermediate-Density-Lipoprotein (IDL) bezeichnet. Es wird von der Leber aufgenommen, wo es entweder abgebaut oder als LDL freigesetzt wird. Es enthält Apo B-100, das an den LDL-Rezeptor in den peripheren Geweben bindet und die Aufnahme erleichtert. HDL sind Partikel, die im Blut gebildet werden. Sie enthalten Apo A-I, das von Hepatozyten oder enterischen Zellen gebildet wird. Das naszierende HDL enthält nur Apolipoproteine. Es nimmt Cholesterin aus nicht hepatischen (peripheren) Geweben auf. Um Cholesterin in HDL einzuschließen, erleichtert das Blutenzym Lecithin-Cholesterin-Acetyltransferase (LCAT) dessen Veresterung. LCAT wird von der Leber synthetisiert und ausgeschieden. HDL gibt die Cholesterinester an die Leber zurück.
FFA: freie Fettsäure.
Mechanismus:
Regulation:

Zelluläre Aufnahme von LDL und Regulation:
Innerhalb der Hepatozyten kann LDL an LDL-Rezeptoren binden, was eine Endozytose ermöglicht. LDL wird vom Rezeptor freigesetzt, der an die Zelloberfläche zurückkehrt. Das LDL-Partikel wird abgebaut und Cholesterin freigesetzt. Dieses Cholesterin kann die Expression von LDL-Rezeptoren herunterregulieren und die weitere Cholesterinsynthese hemmen und kann dann entweder gespeichert oder verwendet (in diesem Fall in Gallensäuren umgewandelt) werden.
ACAT: Acylcholesterin-Acyltransferase, die Cholesterin in Cholesterinester umwandelt
HMG-CoA: 3-Hydroxy-3-methyl-glutaryl-coenzym A

Proproteinkonvertase Subtilisin/Kexin Typ 9 (PCSK9) ist ein Enzym, das von der Leber in den Blutkreislauf sezerniert wird, das an LDL-Rezeptoren (sowohl innerhalb als auch außerhalb der Hepatozyten) bindet und anschließend die Endozytose der LDL-Rezeptoren zum Abbau fördert.
LDL-R: LDL-Rezeptor

Chemische Strukturen von Gallensäuren
Bild von Lecturio.
Übersicht über die Wege der Steroidosynthese:
Cholesterin wird zunächst in Pregnenolon und dann in Progesteron umgewandelt. Von dort divergiert der Weg mit vielen potenziellen Endprodukten, einschließlich Glukokortikoiden, Mineralokortikoiden, Androgenen und Östrogenen.
Bild von Lecturio.
Diagramm, das eine vereinfachte Version der Synthesewege von Steroidhormonen zeigt
Bild von Lecturio.| Synthese Lage |
Klasse | Primäres Hormon | Funktionen |
|---|---|---|---|
| Nebennieren Nebennieren Nebennieren | Glukokortikoide Glukokortikoide Glukokortikoide | Kortison Kortison Glukokortikoide |
|
| Mineralokortikoide | Aldosteron |
|
|
| Gonaden | Gestagene Gestagene Hormonelle Kontrazeptiva | Progesteron Progesteron Gonadenhormone |
|
| Östrogene | Östradiol | Sexuelle Entwicklung, Differenzierung und Reifung von primären und sekundären Geschlechtsmerkmalen | |
| Androgene Androgene Androgene und Antiandrogene | Testosteron Testosteron Androgene und Antiandrogene |