Die Multiple Sklerose (MS) ist eine chronisch-entzündliche Autoimmunerkrankung, die zu einer Demyelinisierung der Nervenfasern Nervenfasern Nervensystem: Histologie im ZNS führt. Junge Frauen sind überwiegend von dieser demyelinisierenden Erkrankung betroffen. Die Ätiologie der MS ist unklar; es wird jedoch angenommen, dass sowohl genetische als auch Umweltfaktoren eine Rolle spielen. Das klinische Erscheinungsbild variiert stark je nach Lokalisation der Läsionen, umfasst jedoch typischerweise neurologische Symptome, die das Sehvermögen, die motorischen Funktionen, die Empfindung und die autonome Funktion beeinträchtigen. Die Diagnose erfolgt mittels MRT MRT Magnetresonanztomographie (MRT) des gesamten ZNS (Gehirn und Wirbelsäule Wirbelsäule Wirbelsäule) sowie Liquoruntersuchung. Die Behandlung umfasst Kortikosteroide für akute Schübe und krankheitsmodifizierende Medikamente, um die Schübe zu reduzieren und das Fortschreiten der Krankheit zu verlangsamen. Die durchschnittliche Lebenserwartung von Menschen mit MS ist um ca. 5–10 Jahre verringert.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Die Multiple Sklerose (MS) ist eine autoimmun vermittelte Erkrankung, die zu einer Demyelinisierung der Nervenfasern Nervenfasern Nervensystem: Histologie des ZNS führt.
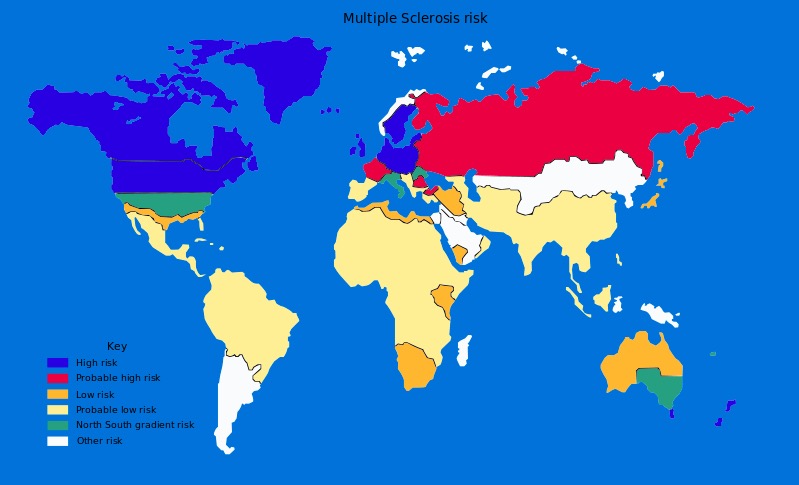
Globale Prävalenz von Multipler Sklerose
Bild: “Multiple sclerosis risk” von Dekoder. Lizenz: Public DomainDie genaue Ätiologie der MS ist unbekannt. Es wird angenommen, dass die Krankheit multifaktoriell bedingt ist, wobei genetische Veranlagung und Umweltfaktoren eine Rolle spielen.
Genetische Faktoren:
Umweltfaktoren:
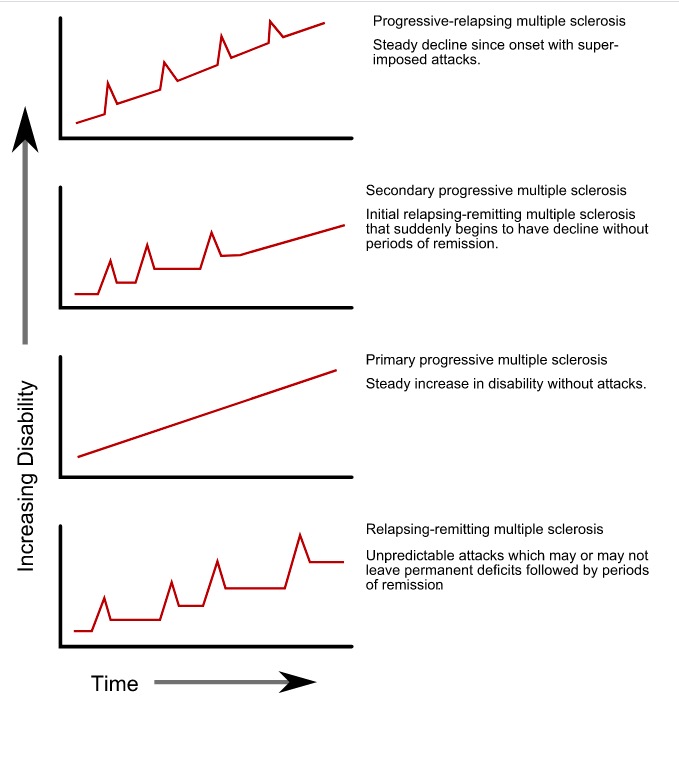
Verlaufsformen der Multiplen Sklerose
Bild: “Progression types of multiple sclerosis” von GetThePapersGetThePapers. Lizenz: Public Domain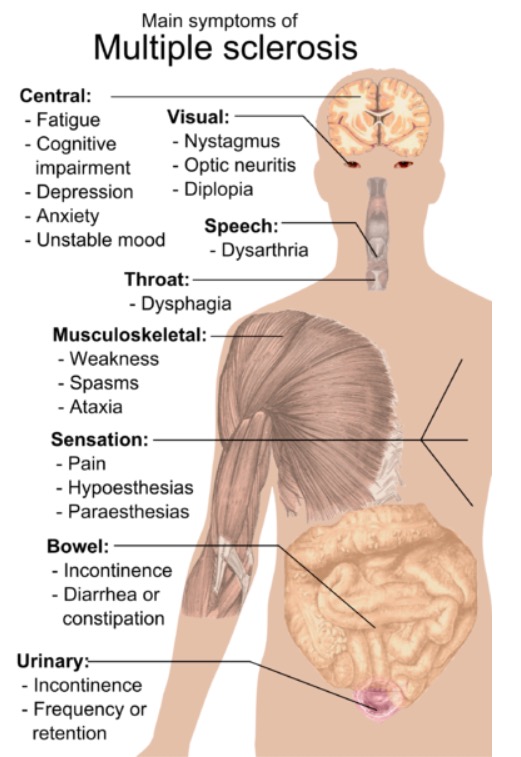
Symptome von Multipler Sklerose
Bild: “Main symptoms of multiple sclerosis” von Mikael Häggström. Lizenz: Public DomainDie MS-Diagnose ist die Ausschlussdiagnose, d.h. neurologische Symptome, die durch eine andere Erkrankung als MS nicht besser erklärt werden können, werden ausgeschlossen. Die Diagnose wird wie folgt gestellt:
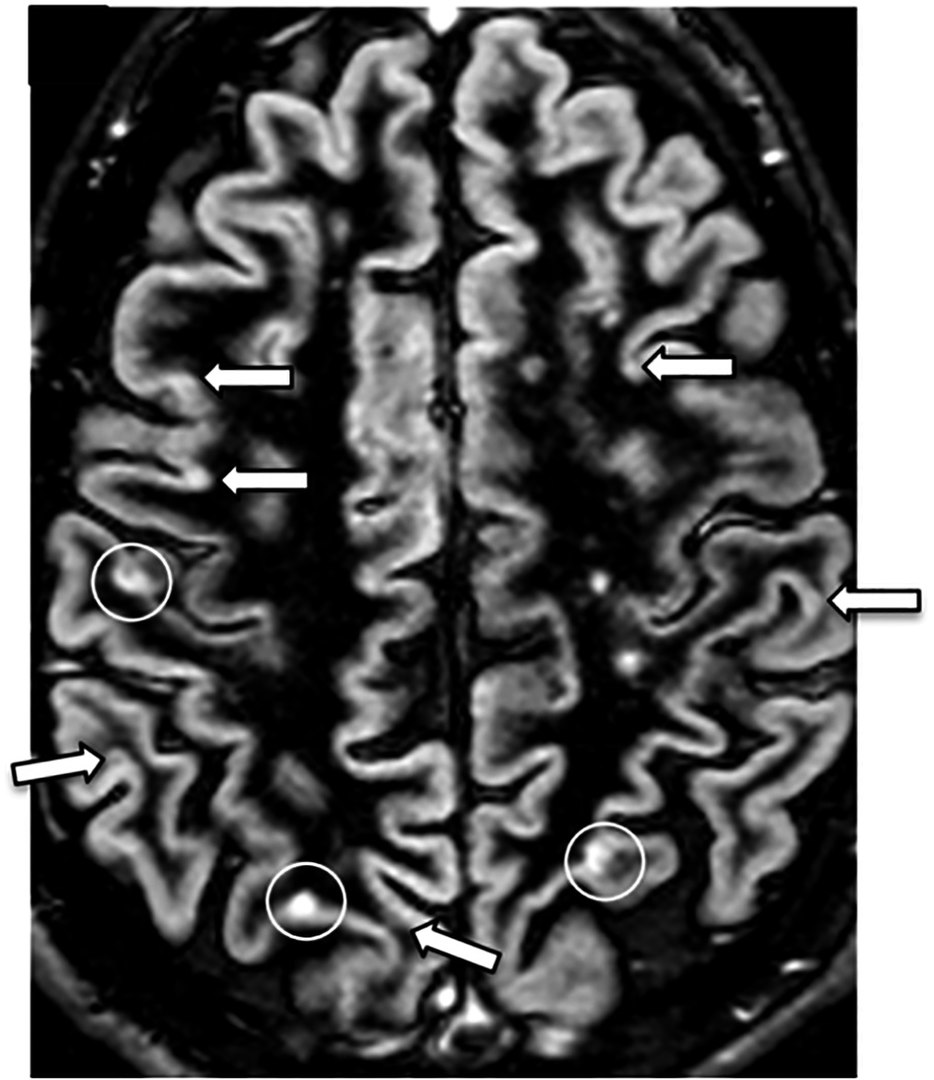
MRT in Double-Inversion-Recovery-Sequenz (DIR-Sequenz):
Derzeit gibt es keine kausale Therapie für MS. Die Behandlungsziele sind die Verbesserung der Symptome, die Verlangsamung des Krankheitsverlaufs und die Erhaltung der Lebensqualität.