Die Hypothalamus- und Hypophysenhormone sind die wichtigsten Regulatoren des endokrinen Systems. Der Hypothalamus Hypothalamus Hypothalamus fungiert als Koordinationszentrum zwischen dem ZNS und dem endokrinen System, indem er die vom Gehirn empfangenen Signale verarbeitet und entsprechende regulatorische Hormone Hormone Endokrines System: Überblick an die Hypophyse Hypophyse Hypophyse (Glandula pituitaria, Hirnanhangsdrüse) entsendet. Die Hypophyse Hypophyse Hypophyse wird daraufhin zur Ausschüttung ihrer eigenen Hormone Hormone Endokrines System: Überblick entweder stimuliert oder gehemmt. Hypophysenhormone regulieren mehrere endokrine Organe, einschließlich der Gonaden, der Schilddrüse Schilddrüse Schilddrüse, der Nebennierenrinde und der Brustdrüse. Hypophysenhormone spielen auch eine entscheidende Rolle für das Wachstum und den Wasser- und Elektrolythaushalt.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Hormone Hormone Endokrines System: Überblick sind Botenstoffe, die in einem Körperteil synthetisiert werden und auf ein anderes Körperteil gezielt regulierende Wirkungen ausüben.
Hypothalamische Hormone Hormone Endokrines System: Überblick:
Hypophysenhormone:
Einige der wichtigsten endokrinen Hormone Hormone Endokrines System: Überblick funktionieren innerhalb einer mehrstufigen negativen Rückkopplungsschleife, die als Achse bekannt ist. Diese Achsen umfassen den Hypothalamus Hypothalamus Hypothalamus, die Hypophyse Hypophyse Hypophyse und mehrere verschiedene periphere endokrin aktive Drüsen.
Allgemeiner Aufbau und Funktion einer Achse:

Hypothalamus-Hypophysen-Achse und deren Regulation durch negatives Feedback. Die Hemmung durch Hormone der Adenohypophyse wird als Short-Feedback-Loop bezeichnet, wohingegen die Hemmung durch die Hormone der peripheren endokrinen Drüsen als Long-Feedback-Loop bezeichnet wird.
Bild von Lecturio.Beispiel: Hypothalamus-Hypophysen-Schilddrüsen-Achse (Thyreotroper Regelkreis):
Die Hormone Hormone Endokrines System: Überblick werden direkt in den Neuronen Neuronen Nervensystem: Histologie des Hypothalamus Hypothalamus Hypothalamus synthetisiert. Die Hormone Hormone Endokrines System: Überblick sind die primären Regulatoren der Hypophyse Hypophyse Hypophyse und somit der primäre Mechanismus, über den das ZNS mit dem endokrinen System kommuniziert.
Der Hypothalamus Hypothalamus Hypothalamus sezerniert Releasing-Hormone oder alternativ Inhibiting-Hormone, die über das hypophysäre Pfortadersymstem (Gefäßkomplex zur Verbindung von Hypothalamus Hypothalamus Hypothalamus mit Hypophyse Hypophyse Hypophyse) zur Adenohypophyse transportiert werden.
Releasing-Hormone:
Inhibiting-Hormone:
Im Gegensatz zur Adenohypophyse werden keine hypothalamischen Hormone Hormone Endokrines System: Überblick in den Blutkreislauf geschüttet, um die Neurohypophyse zu stimulieren. Stattdessen transportiert der Hypothalamus Hypothalamus Hypothalamus die Hormone Hormone Endokrines System: Überblick entlang von Axonen zur Neurohypophyse.
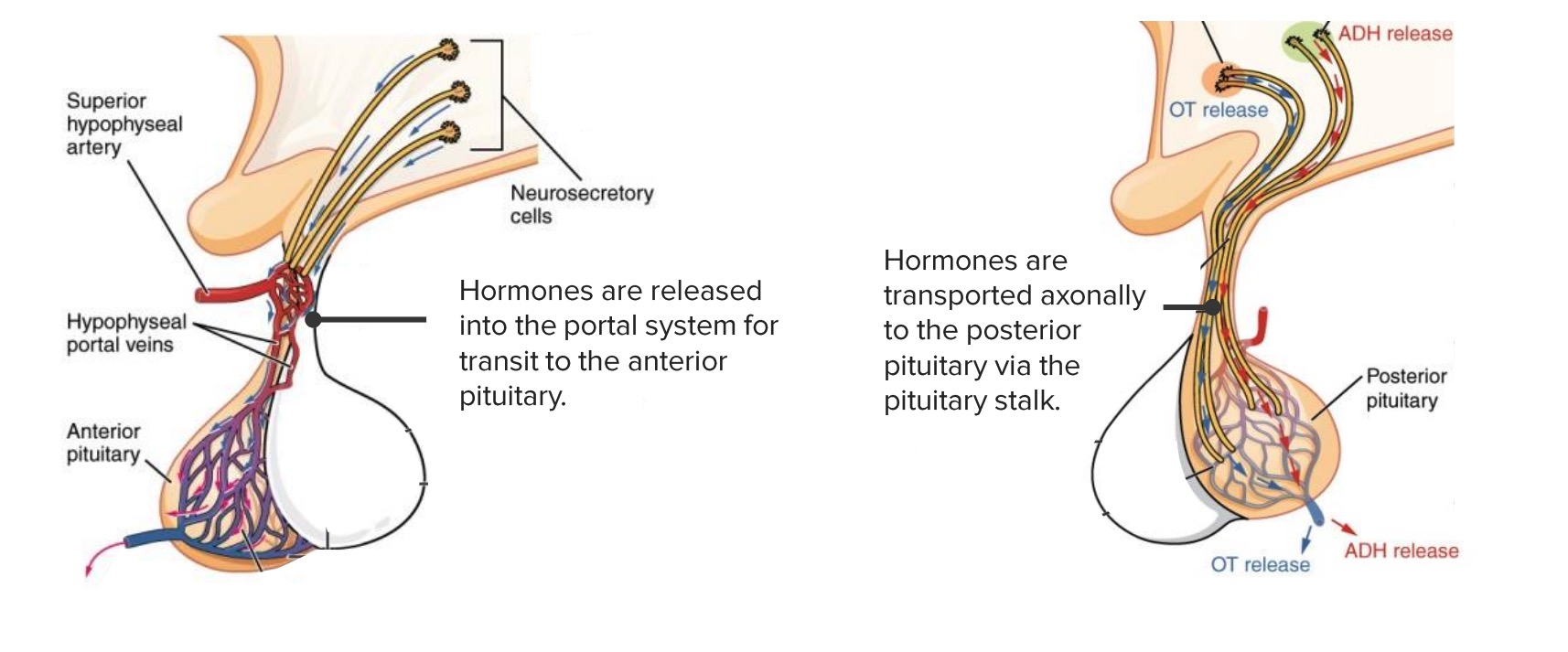
Abbildung der Adeno- und Neurohypophyse und der jeweiligen Kommunikationsformen mit dem Hypothalamus.
Hormonfreisetzung in der Adenohypophyse: Hypothalamische Releasing-Hormone werden in die hypophysären Pfortadervenen ausgeschüttet und gelangen so zur Adenohypophyse. Dort werden die Zielzellen zur Sekretion von adenohypophysären Hormonen in den venösen Kreislauf angeregt.
Hormonfreisetzung in der Neurohypophyse: Die Hormonsynthese findet bereits in den Neuronen des Hypothalamus statt. Mittels axonalem Transport gelangen sie zur Neurohypophyse, von wo aus sie letztendlich in das venöse System sezerniert werden.
Zu den Hormonen der Adenohypophyse gehören:
Axone aus dem Hypothalamus Hypothalamus Hypothalamus transportieren die bereits im Hypothalamus Hypothalamus Hypothalamus synthetisierten Hormone Hormone Endokrines System: Überblick in die Neurohypophyse. Dort werden sie gespeichert und bei Bedarf direkt in den Kreislauf abgegeben. Zu den Hormonen der Neurohypophyse gehören:
| Hypothalamushormon | Zielzellen der Hypophyse Hypophyse Hypophyse | Hypophysenhormon | Zielorgan | Wirkung |
|---|---|---|---|---|
| CRH | Corticotrop | ACTH ACTH Hormone der Nebenniere | Nebennierenrinde | Sezerninerung von Corticosteroiden |
| TRH | Thyreotrop | TSH | Schilddrüse Schilddrüse Schilddrüse | Sezernierung von Schilddrüsenhormonen |
| GnRH | Gonadotrop | FSH | Gonaden: Ovarien Ovarien Ovarien, Hoden Hoden Hoden | Follikelreifung und Spermatogenese |
| LH | Gonaden: Ovarien Ovarien Ovarien, Hoden Hoden Hoden | Androgensynthese (beide Geschlechter), Ovulation (Frauen) | ||
| GHRH | Somatotrp | GH | Viele Organe | Anabole Effekte |
| Somatostatin (Inhibiting-Hormon) | Somatotrop | GH (Hemmung) | Viele Organe | Hemmung anaboler Effekte durch Somatostatin |
| Dopamin (Inhibiting-Hormon) | Lactotrop | Prolaktin (Hemmung) | Milchdrüsen | Hemmung der Milchsynthese durch Dopamin |