Kohlenhydrate (Synonyme: Saccharide) zählen neben den Fetten und den Proteinen zu den drei Makronährstoffen, die dem Körper als Energiequelle dienen. Sie sind die am häufigsten vorkommenden organischen Moleküle in der Natur und die strukturelle Grundlage vieler Organismen. Kohlenhydrate haben vielfältige Funktionen: Sie spielen unter anderem eine essenzielle Rolle im Stoffwechsel, sind Teil der extrazellulären Matrix und der DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA und sie sind obligat für die Zell-Zell-Kommunikation. In der Chemie teilt man Kohlenhydrate anhand der Anzahl an Zuckereinheiten und chemischen Bindungen in einfache und komplexe Kohlenhydrate ein. Die Struktur und der Aufbau der Kohlenhydrate lassen sich einfach anhand der Strukturformel erkennen. Wichtig für die Darstellung der Struktur der Kohlenhydrate sind vor allem die Fischer- und die Haworth-Projektion. Kohlenhydrate haben ein Kohlenstoff-Wasser-Verhältnis von 1:1. Die allgemeine Summenformel lautet Cn(H 2 O)n.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Kohlenhydrate bestehen aus Kohlenstoff, Wasserstoff und Sauerstoff. Sie werden als Aldehyde oder Ketone von Polyalkoholen definiert und haben die allgemeine Summenformel Cn(H2O)n. Kohlenhydrate werden nach der Anzahl der im Molekül vorhandenen Zuckereinheiten definiert:

Haworth-Projektion (bezogen auf die Glucose)
Bild von Lecturio.
D-Glucose in der Fischerprojektion
Bild: „D-glucose in the Fischer projection“ von Ben, Yikrazuul. Lizenz: Public DomainMit diesem Flowchart lassen sich alle Isomerien, nicht nur die der Kohlenhydrate, sondern aller Isomere in der organischen Chemie, identifizieren.

Flowchart aller Isomere in der organischen Chemie
Bild: „Isomerism-ball-V2.de.svg” von Isomerism-ball.svg. Lizenz: CC BY 3.0Erklärung:

Strukturformel zweier Stereoisomere mit Glycerinaldehyd als Bezugsmolekül
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0
Strukturformel zweier Diastereomere
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0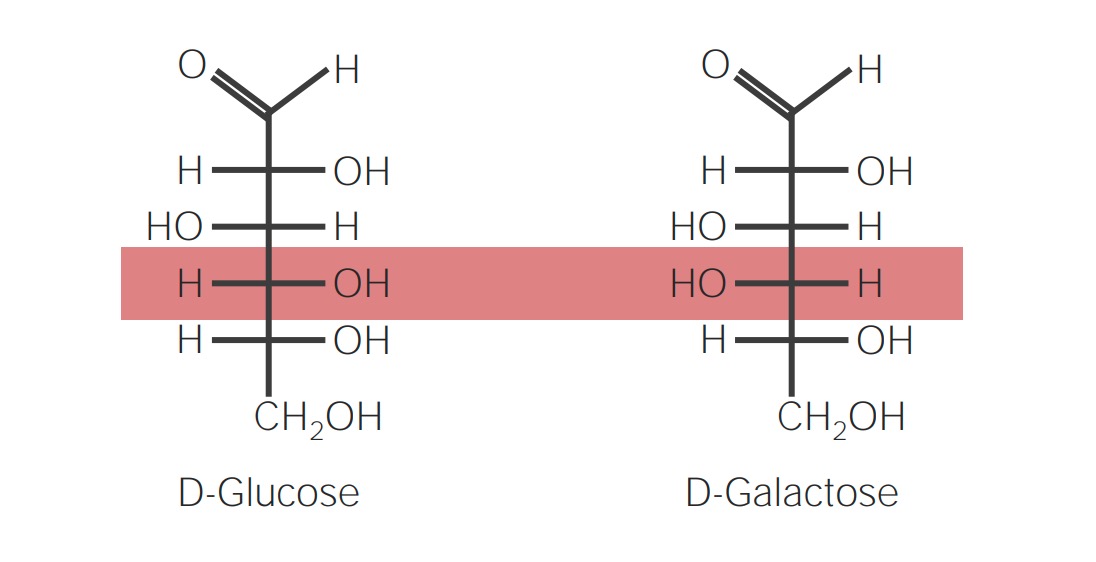
Strukturformel zweier Epimere:
D-Glucose und D-Galactose sind Epimere, die sich in lediglich einem chiralen Zentrum (C4) voneinander unterscheiden.
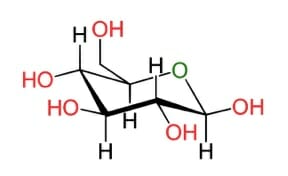
β-D-Glucose in der Sesselkonformation. Die Wasserstoffatome sind axial ausgerichtet.
Bild von LecturioAnomerie:
Nach der Ringbildung entsteht ein neues Chiralitätszentrum am Kohlenstoffatom des ehemaligen Carbonyl-Kohlenstoffs. Es wird als anomeres Zentrum bezeichnet und ist bei Aldosen das 1. Kohlenstoffatom und bei Ketosen das 2. Kohlenstoffatom (stets das Kohlenstoffatom mit der Aldehyd- oder Ketogruppe).
α- und β- Glucosen sind Anomere und können über die offenkettige Form ineinander überführt werden. Da allerdings bei der α-Glucose die OH-Gruppen am C1 und C2– Atom näher beieinander sind als bei der β-Glucose und in der Natur dafür gesorgt wird, dass möglichst energiearme Zustände herrschen, ist das Gleichgewicht auf die Seite der β-Glucose verschoben.

α- und β-Anomere der D-Glucose
Bild: „glucose anomers in Haworth and Fischer projections“ von miguelferig. Lizenz: Public DomainKohlenhydrate werden anhand der Anzahl an Zuckereinheiten in einfache und komplexe Kohlenhydrate eingeteilt.

Disaccharide:
Saccharose, Lactose und Maltose sind wichtigsten Disaccharide. Die Abbildung zeigt die einzelnen Monosaccharid-Bausteine der jeweiligen Disaccharide.
| Art | Beispiele |
|---|---|
| Monosaccharide |
|
| Disaccharide |
|
| Oligosaccharide |
|
| Homoglykane |
|
| Heteroglykane |
|
| Mucopolysaccharide |
|
| Glykoproteine |
|
| Mucoproteine |
|

Amylopektin-Struktur:
Amylopektinmoleküle sind Glukoseketten, die durch α-1,4-glykosidische Bindungen (die eine gerade Kette von Glukosemolekülen bilden) und α-1,6-glykosidische Bindungen (die eine Verzweigung von der geraden Kette bilden) miteinander verbunden sind. Amylase bricht die α-1,4-glykosidischen Bindungen, aber nicht die α-1,6-glykosidischen Bindungen.

Vergleich von α- und β-glykosidischen Bindungen mit Laktose und Maltose:
Der anomere Kohlenstoff in der Galaktose (C1) befindet sich in der β-Konfiguration (die Hydroxylgruppe zeigt nach oben); wenn sich Galaktose also mit dem C4 in der Glukose verbindet, wird eine β-1,4-glykosidische Bindung gebildet. Maltose besteht aus 2 Glukosemolekülen. Der anomere Kohlenstoff in der Glucose (C1) befindet sich in der α-Konfiguration (die Hydroxylgruppe zeigt nach unten); daher ist die Bindung in Maltose eine α-1,4-glykosidische Bindung zwischen 2 Glucosemolekülen.
Optische Aktivität:
Die optische Aktivität ist die Fähigkeit von Stereoisomeren, die Polarisationsebene von linear polarisiertem Licht zu drehen. Je nach Richtung der Lichtrotation werden die Moleküle als rechtsdrehend (+) oder linksdrehend (-) bezeichnet.
Kohlenhydrate haben viele Funktionen. Kohlenhydrate dienen in erster Linie als Nahrungsquelle. Darüber hinaus sind sie strukturelle Bestandteile von Zellen und sind an der Immunabwehr und der intrazellulären Kommunikation beteiligt.
Kohlenhydrate sind für viele Stoffwechselprozesse im Körper von zentraler Bedeutung und umfassen die gesamten biochemischen Prozesse, die für die Bildung, den Abbau und die Umwandlung von Kohlenhydraten in lebenden Organismen verantwortlich sind.
Wichtige Stoffwechselwege:

Diagramm, das die Wege des Kohlenhydratstoffwechsels veranschaulicht
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0