Da menschliche Zellen in erster Linie auf den aeroben Stoffwechsel angewiesen sind, ist es von entscheidender Bedeutung, Sauerstoff effizient aus der Umgebung zu gewinnen und ins Gewebe zu bringen, während das Nebenprodukt der Zellatmung (CO2) ausgeschieden wird. Die Atmung betrifft sowohl das Atmungs- als auch das Kreislaufsystem. Es gibt vier Prozesse, die den Körper mit O2 versorgen und CO2 entsorgen. Das Atmungssystem ist an der Lungenatmung und der äußeren Atmung beteiligt, während das Kreislaufsystem für den Transport und die innere Atmung verantwortlich ist. Die pulmonale Ventilation Ventilation Atemmechanik (Atmung) bezeichnet die Bewegung von Luft in die und aus der Lunge Lunge Lunge: Anatomie. Die äußere Atmung oder der Gasaustausch wird durch den O2- und CO2-Austausch zwischen Lunge Lunge Lunge: Anatomie (Luft) und Blut repräsentiert.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Der Gasaustausch findet auf Höhe der Alveolen in der Lunge Lunge Lunge: Anatomie und in den Kapillaren Kapillaren Kapillaren des Lungenkreislaufs statt.

Schematische Darstellung des gasaustauschenden Atemweges und Aufbau der Alveolen:
1) Bronchiolus respiratorius
2) Alveolarseptum
3) Sacculus alveolaris
4) Kapillaren
5) Typ-II-Penumozyt
6) Typ-I-Pneumozyt
7) Ductus alveolaris
Beim Gasaustausch müssen O₂ und CO₂ die Lungenmembran passieren. Dieser Prozess wird durch mehrere komplexe Kräfte angetrieben, die durch die physikalischen Eigenschaften dieser Gase bestimmt werden.
Die Geschwindigkeit des Gasaustausches wird durch die Effizienz des Austauschs über die Lungenmembran und die Geschwindigkeit bestimmt, mit der das Gas aus der Luft (bei O₂) oder aus dem Körper (bei CO₂) dorthin transportiert werden kann.
O₂ und CO₂ müssen durch den Blutkreislauf transportiert werden, um die Orte des Gasaustausches zu erreichen.

Sättigung von Hämoglobin:
Der Prozentsatz an gebundenem Hämoglobin steigt mit der O2 -Konzentration. Der Buchstabe A zeigt die Sättigung von Hämoglobin im arteriellen Blut (nahezu 99 %) an. Der Buchstabe V bedeutet die Hämoglobinsättigung des venösen Blutes.

Dissoziationskurve von Hämoglobin:
Zeigt die Rechts- und Linksverschiebungen an, die auftreten können, wenn die Sauerstoffzufuhr zum Gewebe erhöht bzw. verringert wird.

Im Plasma transportierte CO2 -Prozentsätze:
90 % des CO2 wird von der Carboanhydrase in HCO3 umgewandelt in den roten Blutkörperchen.
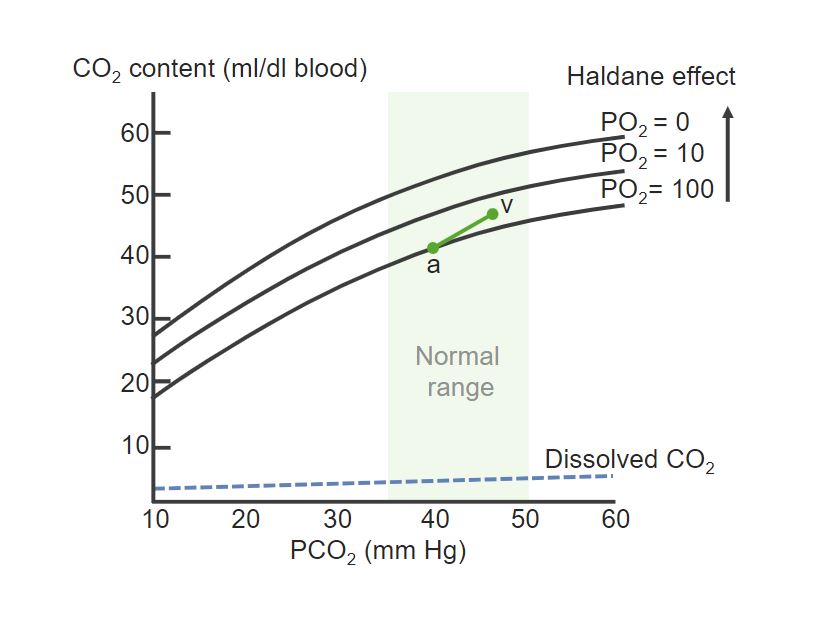
Dissoziationskurve von Hb und CO2:
Der PCO2 von der arteriellen (a) zur venösen Seite (v) steigt an. Die Dissoziationskurve wird mit abnehmendem PO2 erhöht, was darauf hinweist, dass eine niedrige O2-Konzentration mehr CO2 an Hb bindet.
Ventilation Ventilation Atemmechanik und Perfusion sind die Mechanismen, die O₂ und CO₂ zwischen der Lungenmembran und dem Körpergewebe transportieren.
Perfusion ist der Blutfluss zum Lungengefäßsystem.

Schema zur Erläuterung der Mechanismen der Rekrutierung und Distension der Blutgefäße bei Erhöhung des mittleren pulmonal-arteriellen Blutdrucks: A) Einige Gefäße sind geöffnet, leiten aber kein Blut. B) Einige Gefäße sind kollabiert. C) Andere Gefäße sind geöffnet und leiten Blut. D) Zuvor offene, nicht leitende Gefäße leiten nun Blut. E) In der 1. Phase der Rekrutierung werden zuvor kollabierte Gefäße durchlässig, leiten aber kein Blut. F) Später während der Rekrutierung leiten die zuvor kollabierten Gefäße nun Blut. G) In der Zwischenzeit erweitert die Dehnung die zuvor offenen, blutführenden Gefäße. H) Alle Gefäße weiten sich nun, wodurch der Widerstand sinkt.
Bild von Lecturio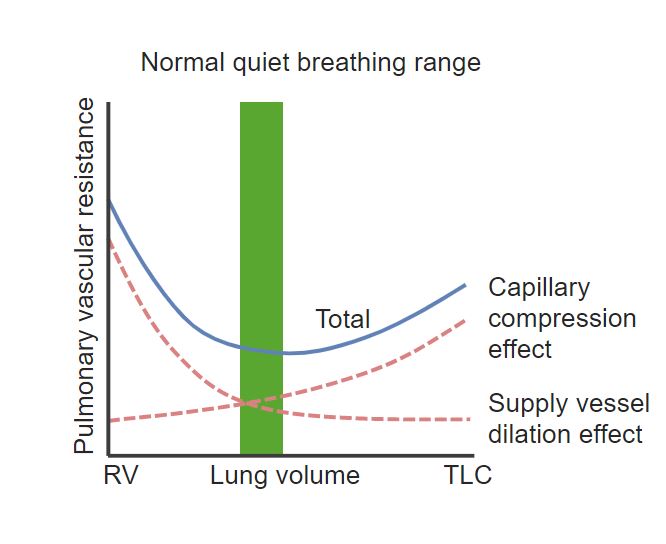
Diagramm, das die Beziehung zwischen Lungenvolumen (x-Achse) und pulmonalem Gefäßwiderstand (y-Achse) zeigt:
Bei geringem Lungenvolumen (RV: Residualvolumen) und bei sehr hohem Lungenvolumen (Total Lung Capacity: TLC) steigt der Gefäßwiderstand.

Diagramm zur Erläuterung der Mechanismen der Rekrutierung und Erweiterung von Blutgefäßen bei Erhöhung des mittleren pulmonalarteriellen Blutdrucks
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0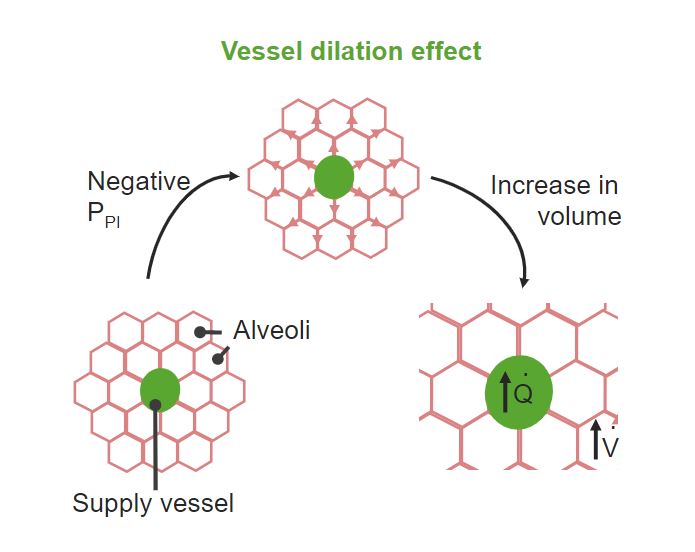
Gefäßerweiterungseffekt:
Der auf die Alveolen ausgeübte negative Pleuradruck dehnt die Wände der Blutgefäße und vergrößert deren Durchmesser.

Übersicht über die Lungendurchblutung
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0
Zone 1 (Apex) der Lunge und die Wirkung der Schwerkraft darauf:
Der arterielle Druck (Pa) ist niedriger als der alveoläre Druck (PA), was den Blutfluss erschwert, wenn nicht unmöglich macht. Die Beziehung zwischen den Drücken ist im grünen Kasten zu sehen.
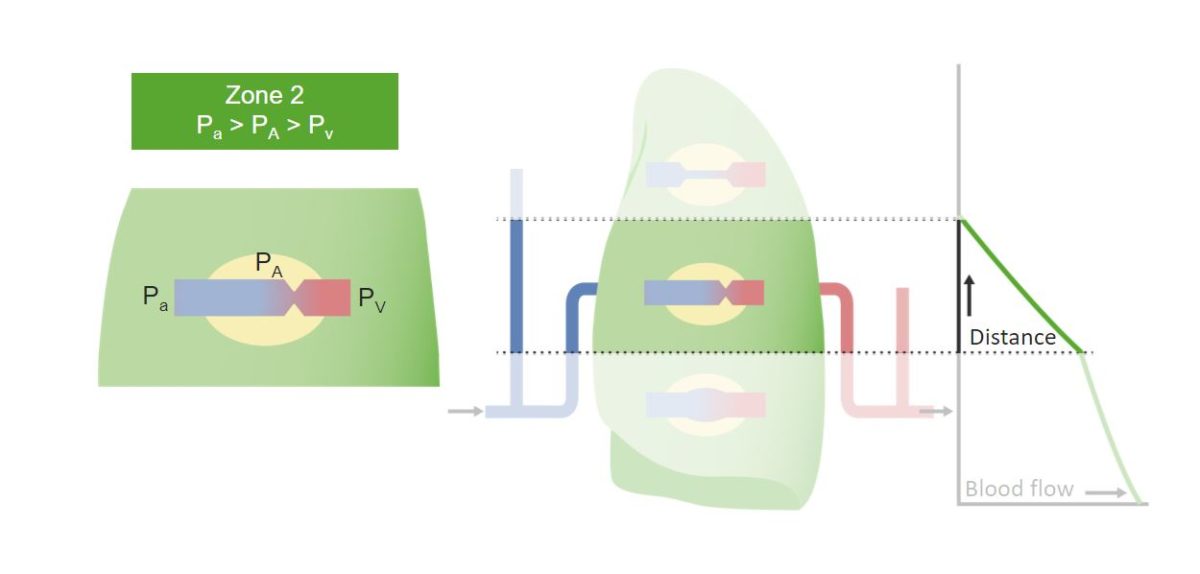
Zone 2 der Lunge und die Wirkung der Schwerkraft darauf:
Durch den Anstieg des arteriellen Blutdrucks wird mehr Blutfluss ermöglicht. Die Beziehung zwischen den Drücken ist im grünen Kasten zu sehen.
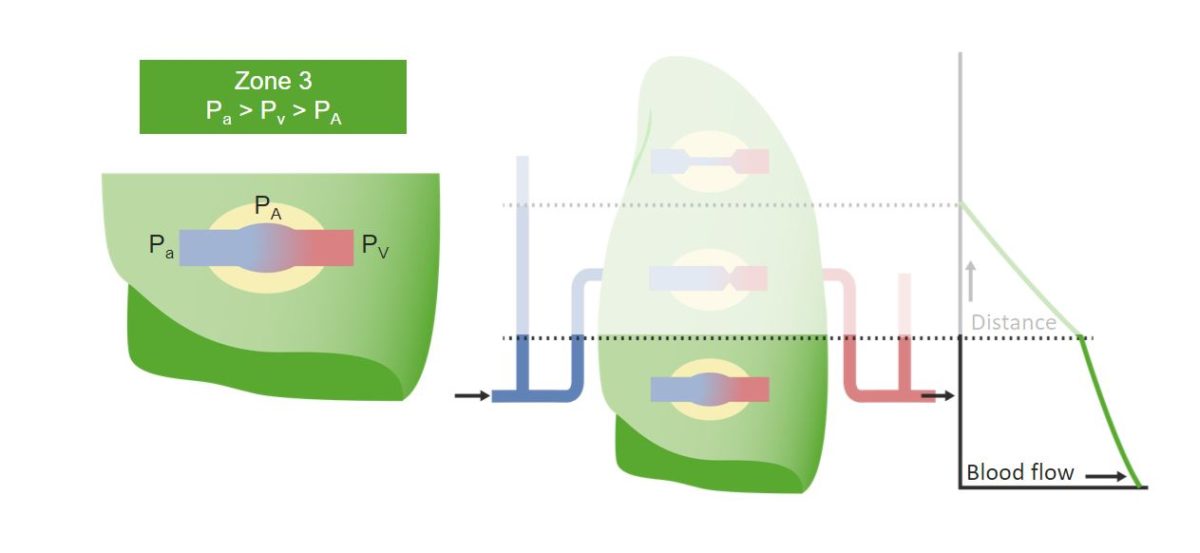
Zone 3 (Basis) der Lunge und die Wirkung der Schwerkraft darauf:
Es ist die Zone mit dem größten Blutfluss in der Lunge. Durch die Schwerkraft steht mehr Blut zur Verfügung und der arterielle Blutdruck ist höher als der alveoläre Druck. Die Beziehung zwischen den Drücken ist im grünen Kasten zu sehen.
Es gibt zwei wichtige PO₂-Unterschiede (Gradienten):

Arteriell-venöser (AV) Unterschied im PO2 zwischen venösem und arteriellem Blut:
Druck von O2 und CO2 in den Alveolen und im systemischen Kreislauf vor und nach dem Gasaustausch.

Schema eines RECHTS-nach-LINKS-Shunts:
Teilweise kann Blut den Gasaustausch überspringen und somit den arteriellen Druck von O2 senken.

PO2 -Gradienten im pulmonalen und systemischen Kreislauf:
Siehe den Aa-Gradienten an der Verbindungsstelle zwischen den Lungenkapillaren und dem systemischen arteriellen Kreislauf. Der AV-Gradient wäre die Differenz zwischen dem PO2 des systemischen arteriellen Kreislaufs vor den Kapillaren und dem PO2 des systemischen venösen Kreislaufs nach den Kapillaren.

Schematische Beispiele für die Abweichung von Ventilation (V) und Perfusion (Q):
Rechts ist ein Beispiel für niedrige Ventilation mit hoher Perfusion zu sehen. Auf der linken Seite ist ein Beispiel für hohe Ventilation zu geringer Perfusion zu sehen. Im Zentrum steht eine normale Situation von Ventilation zu Perfusion mit einem Verhältnis von 1 zu 1.

Ventilations-/Perfusionsbeziehung angewendet auf den Apex der aufrechten Lunge eines gesunden Individuums:
Reduzierte Perfusion des Apex (rechts), die aufblasende Wirkung der Schwerkraft durch das Lungengewicht (Mitte) und die daraus resultierenden Parameter bei der Inspiration (rechts). Der Anstieg des V/Q (V/P)-Verhältnisses aufgrund der erhöhten Ventilation und der reduzierten Perfusion resultiert daraus.
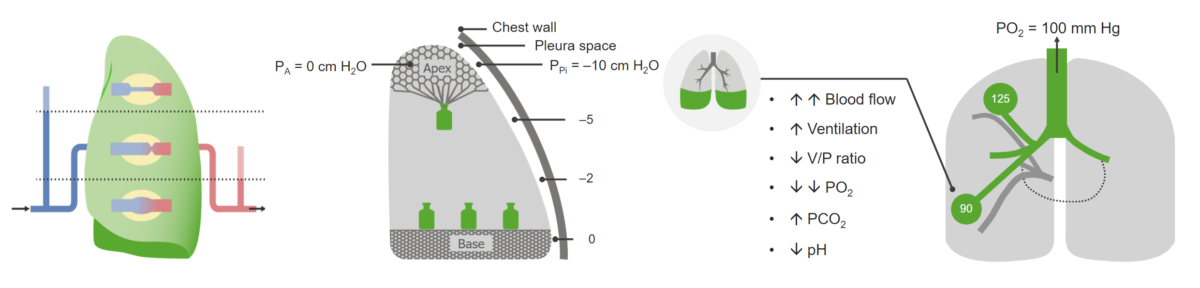
Ventilations-/Perfusionsbeziehung angewendet auf die Basis der aufrechten Lunge eines gesunden Individuums:
Die erhöhte Durchblutung der Basis (rechts), die komprimierende Wirkung der Schwerkraft durch das Lungengewicht (Mitte) und die resultierenden Parameter bei der Inspiration (rechts) sind zu erkennen. Das V/Q (V/P)-Verhältnis wird aufgrund der erhöhten Perfusion verringert.