Nukleinsäuren sind Polymere von Nukleotiden, organischen Molekülen, die aus einem Zucker, einer Phosphatgruppe und einer Stickstoffbase bestehen. Nukleinsäuren sind für die Speicherung, Replikation und Expression genetischer Informationen verantwortlich. Sie sind „Säuren“ wegen der sauren Phosphatgruppen und „Nuklein“, weil sie im Zellkern gespeichert werden. Die zwei am häufigsten in eukaryontischen Zellen vorkommenden Nukleinsäuren sind Desoxyribonukleinsäure Desoxyribonukleinsäure Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA ( DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA) und Ribonukleinsäure Ribonukleinsäure Die Ribonukleinsäure – Aufbau, Struktur und verschiedene Arten von RNA ( RNA RNA Die Ribonukleinsäure – Aufbau, Struktur und verschiedene Arten von RNA). Obwohl sie chemisch ähnlich sind, haben DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA und RNA RNA Die Ribonukleinsäure – Aufbau, Struktur und verschiedene Arten von RNA spezifische biologische Funktionen, auf die ihre jeweiligen Strukturen zugeschnitten sind.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Nukleinsäuren sind Polymere von Nukleotiden.
Hauptklassen:
Nukleotide sind die Grundeinheiten einer Nukleinsäure.
Struktur:
5-Kohlenstoffatomen (=Pentose):
Stickstoffhaltige Basen:
Nukleotide werden durch Hinzufügen von 5’–3′-Phosphodiesterbindungen zu Nukleinsäurepolymeren zusammengesetzt:
Nukleotide benennen:
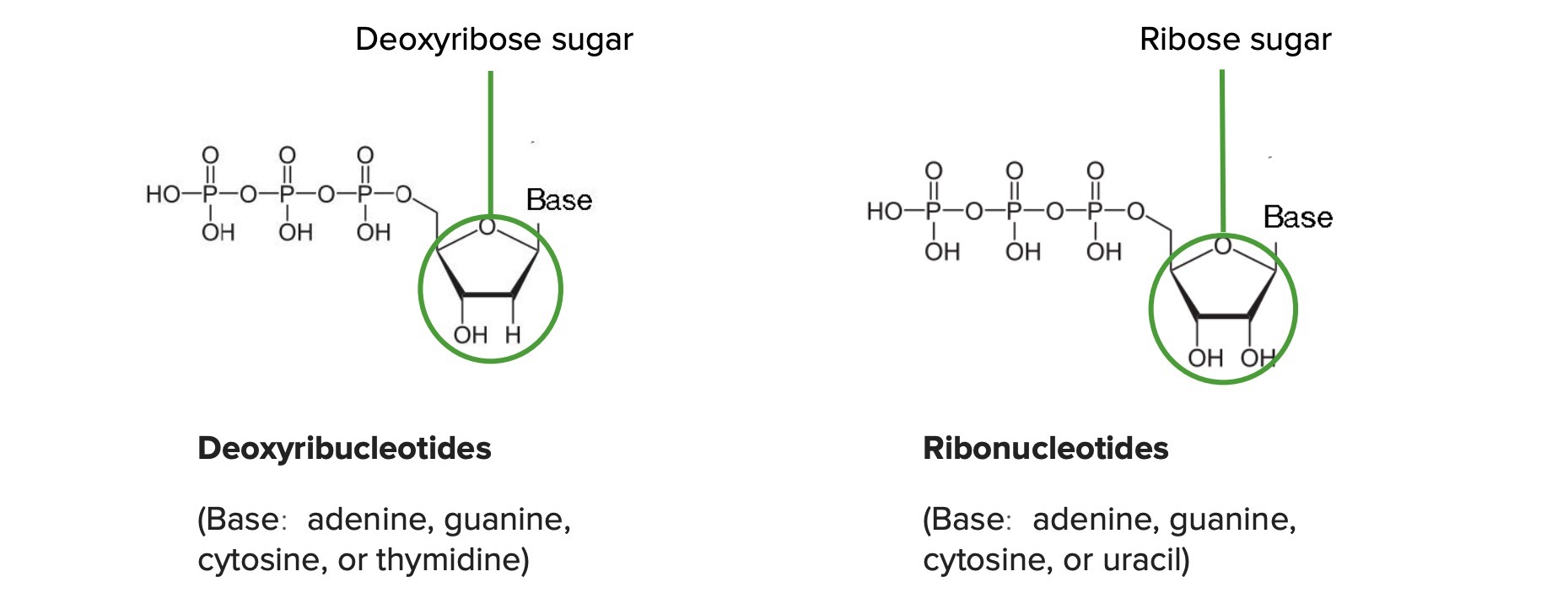
Unterschied zwischen Desoxyribonukleotiden und Ribonukleotiden:
Der 2′-Kohlenstoff ist in DNA an Wasserstoff (H) und in RNA an Hydroxyl (OH) gebunden.

Struktur stickstoffhaltiger Basen: Purine
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0
Struktur stickstoffhaltiger Basen: Pyrimidine
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0
Struktur einer Nukleinsäure:
Beachten Sie die nicht gekoppelten 5′ (P) und 3′ (OH) Enden.
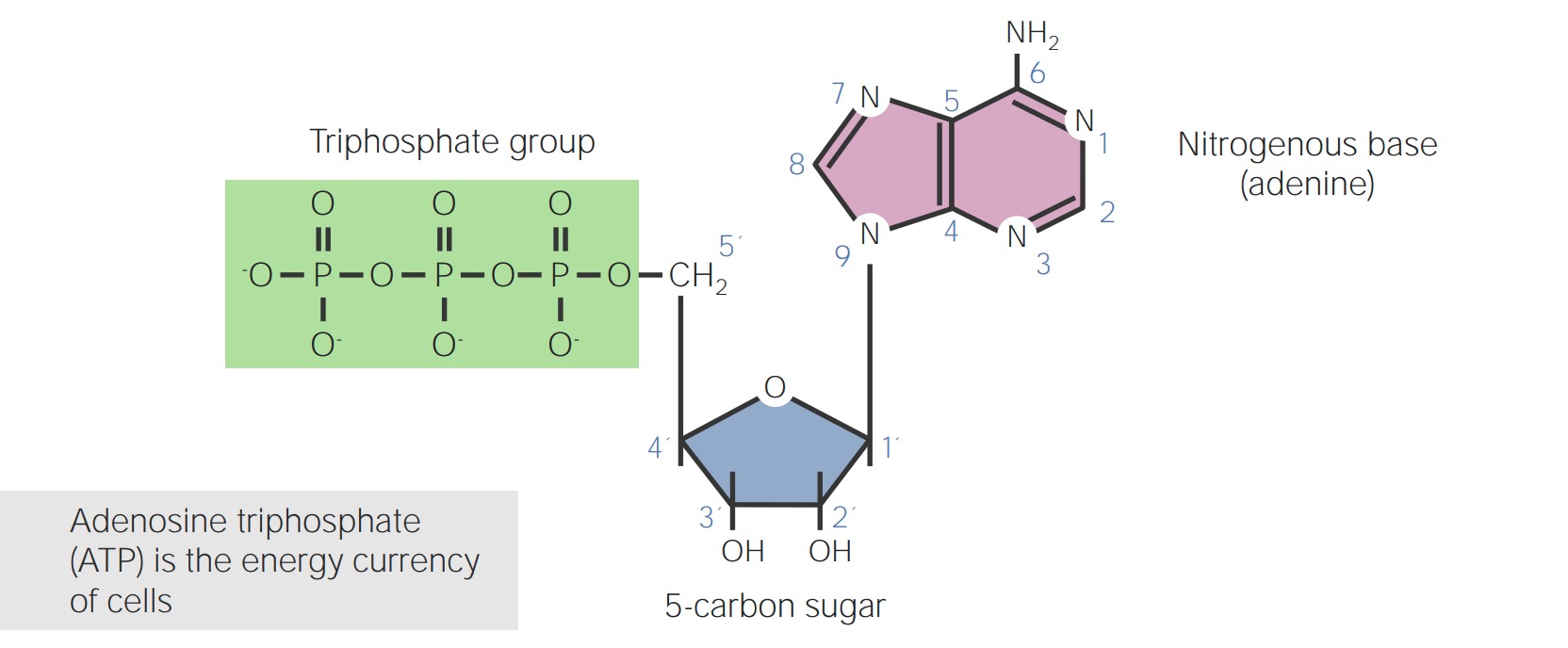
Struktur von Adenosintriphosphat (ATP)
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0DNA DNA Die Desoxyribonukleinsäure – Aufbau, Struktur und verschiedene Arten der DNA ist der genetische Bauplan für das Leben, der Codes für Gene enthält.
RNA RNA Die Ribonukleinsäure – Aufbau, Struktur und verschiedene Arten von RNA: Proteinbiosynthese, regulatorische Funktionen, Verarbeitung und Transport
Für spezialisierte Zwecke für die Phasen der Replikation und Translation von genetischem Material existieren verschiedene Formen von RNA RNA Die Ribonukleinsäure – Aufbau, Struktur und verschiedene Arten von RNA:

Strukturen von RNA und DNA
Bild von Lecturio. Lizenz: CC BY-NC-SA 4.0